Металлы второй группы периодической системы могут быть отнесены к щелочноземельным металлам. Эта группа включает бериллий, магний, кальций, стронций, барий и радий. Каждый из этих металлов обладает уникальными физическими и химическими свойствами, которые определяют его способность взаимодействовать с другими веществами.
Один из наиболее характерных признаков металлов второй группы - это их низкая электроотрицательность. Бериллий имеет самую низкую электроотрицательность в этой группе, что делает его одним из наиболее реакционноспособных металлов. Он быстро реагирует с кислородом, образуя оксиды, которые могут быть использованы в производстве специальных сплавов.
С другой стороны, магний, кальций, стронций и барий обладают большей электроотрицательностью, что делает их более стабильными в воздухе. Эти металлы образуют оксидные пленки на своей поверхности, которые защищают их от окисления. Они также обладают высокими температурами плавления и кипения, что делает их полезными в различных промышленных процессах.
В химических реакциях металлы второй группы могут образовывать ионы с положительным зарядом. Они обычно реагируют с кислотами, образуя соли и выделяя водород. Эти металлы также могут реагировать с водой, но их активность в этом случае уменьшается по мере движения вниз по группе. Барий и радий являются наиболее реакционноспособными металлами второй группы и могут реагировать с водой даже при комнатной температуре. Однако, величина их реакционной способности может быть объяснена изменением радиуса атома и электроотрицательности.
Свойства и реакции
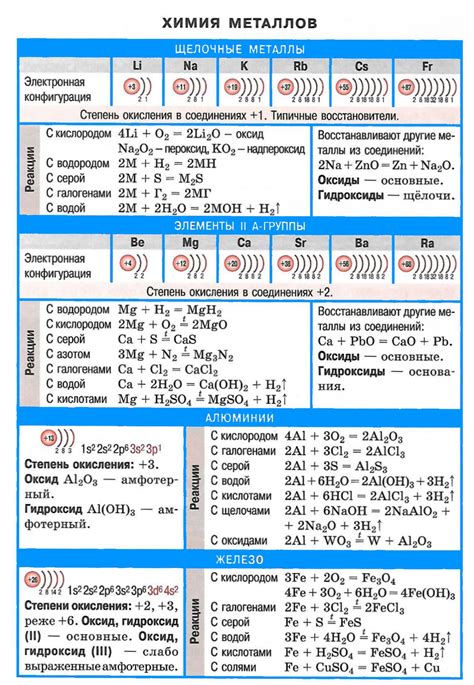
Металлы второй группы таблицы Менделеева имеют ряд характерных свойств. Они относятся к благородным металлам и обладают хорошей проводимостью тепла и электричества. Все они имеют мягкую текстуру и низкую плотность. Кроме того, металлы второй группы образуют двухатомные ионные соединения с отрицательно заряженным атомом, такие как гидриды.
Магний - один из наиболее химически активных металлов второй группы. Он образует оксиды, гидроксиды и соли. Оксид магния (MgO) является основной компонентой плотного материала, называемого магниевым стеклом. Гидроксид магния (Mg(OH)2) обладает щелочными свойствами и часто используется в медицине в качестве желудочного антацида.
Кальций также является химически активным металлом второй группы. Он образует оксиды, гидроксиды и соли, а также многочисленные соединения с аммонием. Гидроксид кальция (Ca(OH)2), известный как известь или недоливка, широко используется в строительстве, а также в процессе нагарообразования при сгорании каменного угля.
Стронций имеет меньшую атомную массу и более низкую плотность по сравнению с магнием и кальцием. В составе атомного реактора стронций используется для поглощения нейтронов, тем самым уменьшая риск ядерного распада радиоактивных изотопов.
Барий является наиболее плотным и тяжелым металлом второй группы. Соединения бария используются в различных отраслях промышленности, например, в производстве ксероксов, в производстве видеоэкранов и в ядерных реакторах.
Металлы второй группы:
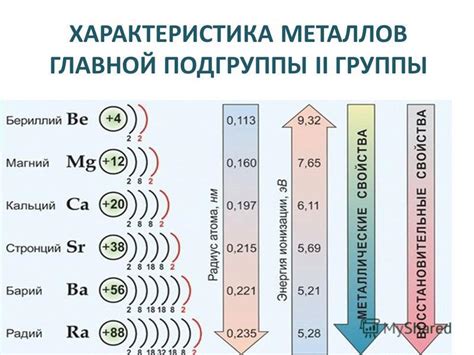
Металлы второй группы, такие как бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra), обладают рядом характеристических свойств.
Бериллий является легким металлом, который обладает высокой твердостью и хорошей электропроводностью. Он также обладает высокой степенью химической инертности и применяется в производстве легированных сплавов и ядерных реакторов.
Магний является одним из наиболее распространенных металлов второй группы. Он хорошо проводит тепло и электричество, легок, но достаточно прочен. Магний также обладает способностью гореть с ярким пламенем, поэтому его часто используют в производстве специальных эффектов и фейерверков.
Кальций, также известный как щелочной земельный металл, является важным элементом для жизни. Он необходим для образования костей и зубов, а также участвует в многих биохимических процессах в организме. Также кальций применяется в производстве стекла и строительных материалов.
Стронций и барий также имеют свои особенности. Стронций образует ярко-красные пламя и используется в пиротехнике, а барий применяется в медицине для проведения рентгеновских исследований.
Радий является самым редким и радиоактивным металлом второй группы. Его свойства делают его опасным для здоровья, поэтому его использование ограничено. Радий ранее применялся в часах и светящихся материалах, однако в настоящее время его применение сильно ограничено из-за его высокой токсичности.
| Металл | Характеристики | Применение |
|---|---|---|
| Бериллий (Be) | Легкость, высокая твердость, химическая инертность | Производство легированных сплавов, ядерные реакторы |
| Магний (Mg) | Высокая электропроводность, горение с ярким пламенем | Производство специальных эффектов, фейерверки |
| Кальций (Ca) | Необходим для образования костей и зубов, участие в биохимических процессах | Производство стекла, строительные материалы |
| Стронций (Sr) | Образование ярко-красного пламени | Пиротехника |
| Барий (Ba) | Применение в медицине для рентгеновских исследований | Медицина |
| Радий (Ra) | Самый редкий и радиоактивный металл второй группы | Ранее использовался в часах, светящихся материалах |
Общие характеристики:

Металлы второй группы периодической системы химических элементов включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти элементы обладают рядом общих характеристик, определяющих их свойства и химические реакции.
Первой характеристикой металлов второй группы является их относительно низкая электронегативность. Это означает, что эти элементы имеют тенденцию отдавать электроны при взаимодействии с другими веществами. Более того, у этих металлов первый и второй ионизационные энергии также невысокие, что способствует образованию положительных ионов при реакциях.
Второй важной характеристикой металлов второй группы является их способность образовывать ионы с валентностью +2. Это происходит благодаря наличию двух валентных электронов во внешней электронной оболочке данных элементов. Эти ионы характеризуются высокой химической активностью и могут образовывать стабильные соединения с различными ан- и катионами.
Третьей общей характеристикой металлов второй группы является их относительно высокая плотность. Объясняется это наличием малого атомного радиуса и частого упорядочения в кристаллической решетке. Эти металлы также обладают высокой теплопроводностью и электропроводностью, что делает их незаменимыми материалами в различных областях науки и промышленности.
Физические свойства:

Металлы второй группы периодической системы – это химический элемент, обладающий определенными физическими свойствами. Все металлы данной группы являются твердыми веществами при комнатной температуре и обладают блестящей поверхностью, которая называется металлическим блеском. Это свойство объясняется наличием свободных электронов, которые ответственны за проводимость электричества и тепла.
- Точка плавления и кипения: У металлов второй группы высокие точки плавления и кипения. К примеру, магний плавится при температуре 650°C, а кипит при 1090°C. Такое свойство объясняется прочными межатомными связями.
- Плотность: Металлы второй группы обладают высокой плотностью. Например, плотность магния – 1,74 г/см³, плотность цинка – 7,13 г/см³. Высокая плотность делает эти металлы крепкими и прочными.
- Хрупкость: Хотя металлы второй группы обычно являются твердыми, некоторые из них могут быть хрупкими. Например, виталлий и кадмий при наблюдении в чистом виде проявляют хрупкость и могут легко ломаться.
Физические свойства металлов второй группы существенно влияют на их использование в различных отраслях промышленности, в том числе в машиностроении и электротехнике.
Химические свойства:

Металлы второй группы периодической системы элементов обладают рядом характерных химических свойств.
Во-первых, они вступают в реакции с кислородом. При нагревании они окисляются до соответствующих оксидов металлов. Например, магний горит в воздухе с образованием оксида магния MgO.
Во-вторых, эти металлы реагируют с водой. При взаимодействии с водой они образуют гидроксиды. Например, кальций реагирует с водой, образуя гидроксид кальция Ca(OH)2 и выделяя водород H2.
В-третьих, они реагируют с кислотами. При взаимодействии с кислотой образуется соответствующая соль и выделяется водород. Например, цинк реагирует с соляной кислотой HCl, образуя хлорид цинка ZnCl2 и выделяя водород H2.
Также стоит отметить, что металлы второй группы обладают хорошей проводимостью электричества и тепла, что делает их важными материалами в электротехнике и строительстве.
Реакции металлов второй группы:
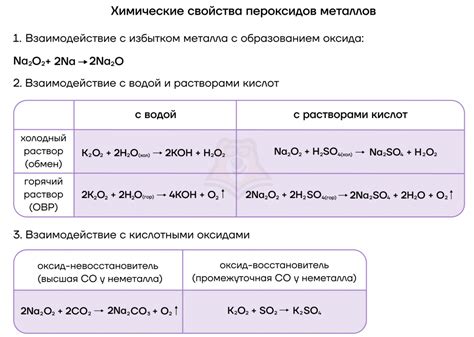
Металлы второй группы периодической системы (магний, цинк, кадмий) проявляют различные химические свойства и реакции взаимодействия с другими веществами.
Магний – активный металл, способный сгорать на воздухе с ярким пламенем. С раствором воды оно реагирует, образуя гидроксид магния и выделяя водород. Он также вступает в реакцию с кислородом при высоких температурах, образуя оксид магния.
Цинк не реагирует с водой при обычных условиях, но при нагревании активно с ней взаимодействует, выделяя водород. Он растворяется в кислотах, образуя соли, при этом также выделяется водород. Цинк вступает в реакцию с кислородом, образуя оксид цинка.
Кадмий подобно цинку не реагирует с водой при обычных условиях, но растворяется в кислотах, образуя соли. Кадмий может образовывать разные оксиды, такие как оксид кадмия и оксид кадмия(II). Кроме того, кадмий может вступать в реакцию со солями других металлов, образуя осадок.
Таким образом, металлы второй группы проявляют свои химические свойства в различных реакциях с веществами, что является основой для их использования в различных областях.
Вопрос-ответ

Какие свойства обладают металлы второй группы?
Металлы второй группы характеризуются следующими свойствами: мягкость, блеск, хорошая проводимость тепла и электричества, высокая пластичность и ductilitу. Они также реагируют с кислородом, образуя основания и гидроксиды.
Какие химические реакции могут происходить с металлами второй группы?
Металлы второй группы могут реагировать с кислородом, образуя основания и гидроксиды. Они также могут образовывать соли с другими элементами, реагировать с кислотами и вступать в реакцию с некоторыми не металлами. Кроме того, они обладают способностью амфотерности и могут реагировать как с кислотами, так и с основаниями.
