Разведенная азотная кислота, также известная как азотная кислота с концентрацией менее 70%, является одним из основных химических соединений, используемых в лабораторной практике. Она широко применяется в химическом анализе, производстве удобрений и взрывчатых веществ. Однако, разведенная азотная кислота обладает высокой химической активностью и может взаимодействовать с различными металлами.
Взаимодействие металлов с разведенной азотной кислотой приводит к образованию солей и выделению газа. Некоторые металлы, такие как медь, серебро и золото, не реагируют с азотной кислотой, поскольку они относительно инертны к кислотному окислительному воздействию. Однако, более активные металлы, такие как цинк и железо, могут вступать в реакцию с азотной кислотой.
При взаимодействии металлов с разведенной азотной кислотой происходит окислительно-восстановительная реакция. Металл окисляется, а азотная кислота восстанавливается. В результате реакции образуется азотистая кислота и соль соответствующего металла. Кроме того, образуется и выделяется диоксид азота, который имеет ярко-красный цвет и характерный запах.
Металлы и азотная кислота: взаимодействие и химические реакции
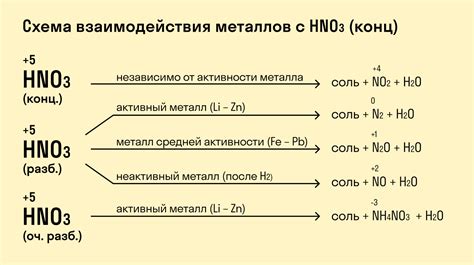
Взаимодействие металлов с разведенной азотной кислотой является одной из важных химических реакций. Азотная кислота, также известная как азотная кислота, характеризуется высокой реакционной активностью и остро выраженными окислительными свойствами.
При контакте с металлами азотная кислота претерпевает окислительно-восстановительные реакции. В процессе взаимодействия металла и азотной кислоты происходит образование азотных оксидов, таких как оксид азота (II) и оксид азота (IV). Эти оксиды образуются за счет протекания реакции между азотной кислотой и активным металлом, например, натрием или калием.
Химические реакции взаимодействия металлов с азотной кислотой могут быть представлены следующим образом:
- 4KMg + 10HNO3 → 4KNO3 + 4Mg(NO3)2 + 5H2O
- 3Zn + 8HNO3 → 3Zn(NO3)2 + 4H2O + 2NO
В результате этих реакций образуются соли нитратов, а также выделяются газы оксид азота (II) и оксид азота (IV) в виде голубых и красно-бурых паров соответственно.
Взаимодействие металлов с разведенной азотной кислотой является важным фактором в промышленности, где оно используется для получения соответствующих солей и реактивов, а также может быть использовано в аналитической химии для определения идентичности и количественного содержания металлов.
Влияние металлов на разведенную азотную кислоту

Разведенная азотная кислота (HNO3) - это сильная окислительная кислота, которая может взаимодействовать с различными металлами. Влияние металлов на разведенную азотную кислоту может проявляться в виде различных реакций и химических изменений.
Одно из влияний металлов на разведенную азотную кислоту - их растворение. Некоторые металлы, такие как железо (Fe) и цинк (Zn), могут растворяться в азотной кислоте с образованием соответствующих солей, например, нитрата железа (III) и нитрата цинка.
Кроме того, разведенная азотная кислота может окислять металлы. Например, медь (Cu) может окисляться до двухвалентного и трехвалентного купруса, образуя нитрат меди (II) и нитрат меди (III) соответственно. При этом азотная кислота сама редуцируется до оксида азота (NO2) или диоксида азота (NO2).
Некоторые металлы также могут каталитически влиять на реакцию окисления азотной кислоты. Например, платина (Pt) и родий (Rh) могут ускорить окисление азотной кислоты и снизить температуру необходимого нагревания для этой реакции.
Таким образом, взаимодействие металлов с разведенной азотной кислотой может быть разнообразным и зависит от свойств конкретного металла, его растворимости и каталитической активности. Это важно учитывать при проведении различных химических реакций и процессов, связанных с азотной кислотой и металлами.
Формирование нитратов и нитритов в реакциях металлов с азотной кислотой
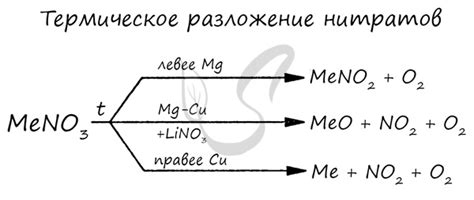
Взаимодействие металлов с разведенной азотной кислотой приводит к образованию нитратов и нитритов. Эти соединения являются солями азотной кислоты и важными химическими веществами.
При реакции металла с азотной кислотой происходит окисление металла со смещением атомного водорода, и как результат образуются нитраты или нитриты металла.
В реакции сильных металлов, таких как водород, калий, натрий, аммоний, образуются нитраты металла. Например, реакция водорода с азотной кислотой приводит к образованию нитрата водорода (HNО3).
В реакции менее активных металлов, таких как медь, железо, свинец, образуются нитриты металла. Нитриты могут образовывать в растворе нитритную кислоту (HNO2). Например, реакция меди с азотной кислотой приводит к образованию нитрита меди (Cu(NO2)2).
Образование нитратов и нитритов металлов в реакциях с азотной кислотой является важным химическим процессом, который может использоваться в промышленности и химической лаборатории для получения этих соединений. Нитраты и нитриты металлов имеют различные применения в различных отраслях, таких как пищевая промышленность, фармацевтика, сельское хозяйство и многие другие.
Взаимодействие азотной кислоты с металлическими оксидами и гидроксидами
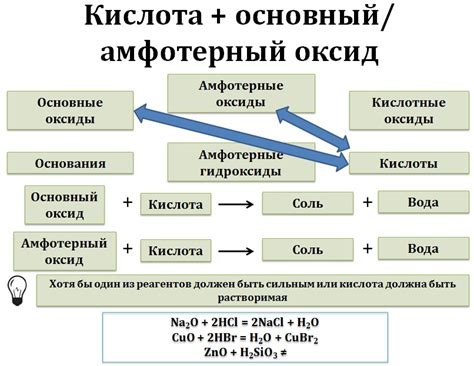
Азотная кислота (HNO3) взаимодействует с металлическими оксидами и гидроксидами, образуя соответствующие соли. Процесс этого взаимодействия имеет свои особенности в зависимости от свойств металла и концентрации азотной кислоты.
При взаимодействии азотной кислоты с металлическими оксидами, происходит образование нитратов. Примером такой реакции может служить взаимодействие магния с азотной кислотой:
MgO + 2HNO3 -> Mg(NO3)2 + H2O
При этой реакции магний окисляется, а азотная кислота восстановляется. Образовавшийся нитрат магния является растворимым и может быть получен в виде кристаллов или порошка.
Взаимодействие азотной кислоты с металлическими гидроксидами также приводит к образованию нитратов. Например, хорошо известен процесс, при котором гидроксид натрия реагирует с азотной кислотой:
NaOH + HNO3 -> NaNO3 + H2O
В результате этой реакции образуется нитрат натрия и вода. Отметим, что нитрат натрия является сильно растворимым в воде соединением и широко применяется в различных отраслях промышленности.
Таким образом, взаимодействие азотной кислоты с металлическими оксидами и гидроксидами приводит к образованию нитратов, которые могут быть использованы в различных сферах человеческой деятельности, в том числе в производстве удобрений и взрывчатых веществ.
Химические свойства нитратов и нитритов, получаемых из азотной кислоты
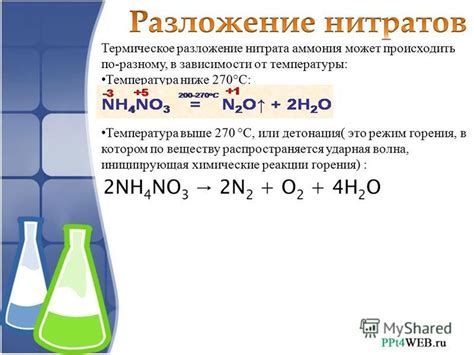
Нитраты – это соли азотной кислоты, получаемые путем реакции металла с разведенной азотной кислотой. Нитраты обладают высокой растворимостью в воде и легко ионизируются, образуя ионы нитрата (NO3-). Они являются хорошими окислителями и могут поддерживать горение.
В результате взаимодействия различных металлов с азотной кислотой образуются разнообразные нитраты. Например, образование нитрата калия (KNO3) происходит при реакции калия с азотной кислотой:
2K(s) + 2HNO3(l) → 2KNO3(aq) + H2(g)
Другим примером является реакция железа с азотной кислотой, в результате которой образуется нитрат железа (III) (Fe(NO3)3):
2Fe(s) + 6HNO3(l) → 2Fe(NO3)3(aq) + 3H2O(l) + NO(g)
Нитриты – это соли гидроксиламида азотной кислоты, получаемые путем соединения металла с разведенной азотной кислотой. Нитриты обладают меньшей растворимостью в воде по сравнению с нитратами и часто используются в качестве консервантов в пищевой промышленности. Они также могут использоваться в качестве антиокислителей в лекарственных препаратах и других химических препаратах.
Примером реакции образования нитритов является взаимодействие натрия с азотной кислотой:
2Na(s) + 2HNO2(l) → 2NaNO2(aq) + H2(g)
Известно также образование нитрита калия (KNO2) при реакции природного натрия с азотной кислотой:
2K(s) + 2HNO2(l) → 2KNO2(aq) + H2(g)
Важно отметить, что нитраты и нитриты обладают различными свойствами и могут использоваться в различных химических и промышленных процессах в зависимости от их специфических химических характеристик и свойств.
Применение нитратов и нитритов в промышленности и сельском хозяйстве
Нитраты и нитриты являются широко применяемыми веществами в различных отраслях промышленности и сельского хозяйства. Они используются как кислотные окислители, консерванты, удобрения и важные компоненты в производстве различных товаров.
В промышленности нитраты и нитриты используются в производстве взрывчатых веществ, добывающей и металлургической промышленности. Кроме того, они входят в состав смазочных материалов и применяются для получения высокоэнергетических соединений. Нитраты и нитриты также используются в процессе производства стекла, пластмасс, красителей и других химических веществ.
В сельском хозяйстве нитраты и нитриты широко применяются в качестве удобрений. Они содержат азот, необходимый для роста и развития растений. Нитраты способствуют повышению урожайности и улучшению качества плодов и овощей. Однако, их неконтролируемое использование может привести к загрязнению почвы и воды, а также к накоплению нитратов в пищевых продуктах и возможным вредным последствиям для здоровья.
Кроме того, нитраты и нитриты используются в пищевой промышленности как консерванты. Они увеличивают срок хранения продуктов, придают им свежесть и яркость цвета. Однако, чрезмерное потребление продуктов, содержащих нитраты и нитриты, может быть вредным для организма человека и привести к развитию некоторых заболеваний.
Опасности и меры предосторожности при работе с азотной кислотой и её производными

Опасности
- Азотная кислота является сильным окислителем и коррозивным материалом. При попадании на кожу, глаза или слизистые оболочки она может вызвать серьезные ожоги.
- Взаимодействие азотной кислоты с органическими веществами, особенно с органическими растворителями, может привести к возникновению взрывоопасных смесей.
- При нагревании азотной кислоты она может разлагаться с образованием высокотоксичных продуктов, таких как оксиды азота.
Меры предосторожности
- При работе с азотной кислотой необходимо соблюдать все необходимые меры безопасности, такие как использование защитной одежды, перчаток, защитных очков и маски.
- Работы следует проводить в хорошо проветриваемых помещениях или под вытяжным шкафом для уменьшения риска вдыхания паров азотной кислоты.
- При работе с азотной кислотой следует избегать контакта с органическими веществами или растворителями.
- При хранении азотной кислоты необходимо соблюдать все указания по безопасности, хранить ее в специально оборудованных хранилищах и избегать высоких температур.
- При разливе азотной кислоты следует быть особенно осторожными для предотвращения возможных попаданий на кожу или в глаза.
Работа с азотной кислотой требует особой ответственности и должна проводиться только специалистами, прошедшими обучение по безопасному обращению с этим веществом.
Перспективы исследования взаимодействия металлов с разведенной азотной кислотой

Металлы и азотная кислота представляют большой научный интерес из-за своих важных применений и потенциальной опасности.
Азотная кислота широко используется в промышленности и технологии, в том числе в производстве удобрений, взрывчатых веществ и лекарственных препаратов. Взаимодействие металлов с азотной кислотой может привести к образованию сложных соединений, изменению их физических и химических свойств, а также возникновению реакций, которые могут быть использованы в промышленности и науке.
Одним из перспективных направлений исследования является изучение возможности использования взаимодействия металлов с разведенной азотной кислотой в качестве катализаторов химических реакций. Металлы могут влиять на скорость реакции, выбор продуктов и стабильность реакционного смеси. Исследования в этой области могут привести к разработке новых эффективных катализаторов, которые будут применяться в промышленных искусственных процессах.
Другим важным аспектом изучения взаимодействия металлов с азотной кислотой является понимание и контроль их коррозионных свойств. Металлы могут быть подвержены коррозии при взаимодействии с агрессивными химическими веществами, такими как азотная кислота. Исследования в этой области могут привести к разработке методов защиты металлических конструкций от коррозии и повысить их стойкость к действию агрессивных сред.
Также, изучение взаимодействия металлов с разведенной азотной кислотой может способствовать разработке новых способов переработки отходов, содержащих металлы. Азотная кислота может участвовать в процессах растворения металлических отходов, что позволяет извлекать ценные компоненты и снижать воздействие этих отходов на окружающую среду. Исследования в этой области могут привести к разработке эффективных и экологически безопасных методов переработки металлических отходов.
Вопрос-ответ

Какие металлы взаимодействуют с разведенной азотной кислотой?
Многие металлы могут взаимодействовать с разведенной азотной кислотой. Например, цинк, железо, медь и алюминий. Взаимодействие может происходить из-за окисления металла или образования соединений с азотной кислотой.
Каковы результаты взаимодействия металлов с разведенной азотной кислотой?
Результаты взаимодействия металлов с разведенной азотной кислотой могут быть разными. Например, некоторые металлы могут растворяться в азотной кислоте, образуя соединения. Другие металлы могут окисляться и выделяться газы, такие как азот и оксиды азота.
Почему металлы взаимодействуют с разведенной азотной кислотой?
Металлы взаимодействуют с разведенной азотной кислотой из-за их химических свойств и реакционной способности. Азотная кислота является сильным окислителем и способна окислять металлы, приводя к образованию соединений или растворению металлов.
Есть ли металлы, которые не взаимодействуют с разведенной азотной кислотой?
Да, есть металлы, которые не взаимодействуют с разведенной азотной кислотой или взаимодействуют очень медленно. Например, золото и платина являются химически инертными металлами и не реагируют с азотной кислотой.
В каких областях применяется взаимодействие металлов с разведенной азотной кислотой?
Взаимодействие металлов с разведенной азотной кислотой находит применение в различных областях. Например, в химическом анализе использование азотной кислоты может помочь определить наличие или содержание определенных металлов в образце. Также, это взаимодействие может использоваться в процессе очистки или очистки поверхности металлов от загрязнений.
