Металлы играют важную роль в химии и промышленности. Они обладают высокой тепло- и электропроводностью, имеют блестящую поверхность и образуют ионы с положительным зарядом. Расположение металлов в периодической системе химических элементов определено их атомными свойствами и химическими реакциями.
Металлы находятся на левой стороне периодической системы, включая блоки s, p и d. Блок s включает щелочные и щелочноземельные металлы, такие как литий, натрий, калий, магний и кальций. Они хорошо растворимы в воде и обладают высокой реактивностью. Блок p включает металлы агрегатных состояний, такие как алюминий, железо, медь, цинк и олово. Они обладают высокой стойкостью к коррозии и имеют различные применения в промышленности и строительстве.
Блок d включает переходные металлы, такие как железо, никель, медь, цинк и серебро. Они обладают высокой плотностью, тугоплавкостью и химической активностью. Эти металлы имеют широкое применение в производстве стали и других материалов. Отдельно стоит отметить блок f, который включает редкоземельные металлы. Они обладают уникальными химическими и физическими свойствами и широко используются в технологии и электронике.
Расположение металлов
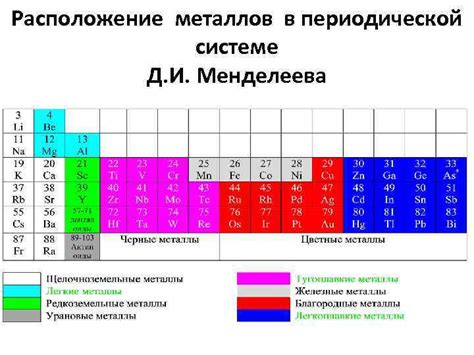
Металлы в периодической системе химических элементов занимают значительную часть таблицы. Они располагаются как в левой, так и в правой ее части. Основные группы металлов представлены семьей щелочных металлов, семьей щелочноземельных металлов, семью элементов платины, а также широкой группой переходных металлов.
Переходные металлы расположены в доле расширенного блока d-элементов периодической системы. Они обладают высокой химической активностью и образуют большое количество ионообменных соединений. Кроме того, они играют важную роль в катализаторах и электрохимических процессах.
Щелочные металлы и щелочноземельные металлы, расположенные в первых двух группах периодической системы, характеризуются низкой плотностью и низкой температурой плавления. Они активно реагируют с водой и кислородом, образуя гидроксиды и оксиды. Кроме того, они обладают высокой электропроводностью и используются в различных отраслях промышленности.
Семья элементов платины, состоящая из шести элементов, является одной из самых драгоценных групп металлов в периодической системе. Эти металлы отличаются высокой термической и химической стабильностью, а также высокой электропроводностью. Они широко используются в производстве ювелирных изделий, электроники и катализаторов.
Расположение металлов в периодической системе
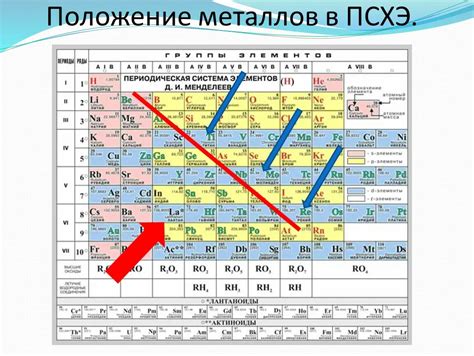
Периодическая система химических элементов представляет собой удобное графическое представление всех известных элементов. В ней металлы занимают особое место, так как именно они составляют большую часть всех элементов.
Металлы в периодической системе расположены слева от черты, которая делит таблицу на металлы и неметаллы. Они подразделяются на две группы: благородные металлы и активные металлы.
Благородные металлы представлены в группе переходных металлов и включают такие элементы, как золото (Au), серебро (Ag) и платина (Pt). Эти металлы обладают высокой химической инертностью и обычно не вступают в активные химические реакции.
Активные металлы находятся в группах 1 и 2 периодической системы и включают такие элементы, как натрий (Na), калий (K) и железо (Fe). Они хорошо взаимодействуют с другими элементами и образуют различные соединения.
Металлы также расположены в периодической таблице в порядке возрастания атомного номера. Таким образом, можно узнать, что большинство металлов находятся в левой части таблицы, а наиболее редкие и тяжелые металлы расположены в правой части.
Необходимо отметить, что наличие металлов в периодической системе демонстрирует их значимость и широкое применение в различных областях науки и техники.
Расположение химических элементов в периодической системе
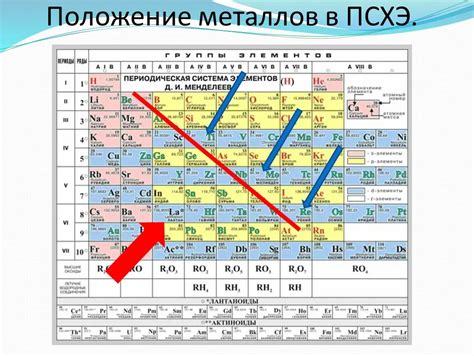
Периодическая система химических элементов представляет собой удобное и систематическое представление всех известных элементов, изображенных в виде таблицы. Расположение этих элементов в периодической системе основано на их атомных номерах, массовых числах и химических свойствах.
Периодическая система состоит из нескольких строк, называемых периодами, и нескольких столбцов, называемых группами. Каждая группа содержит элементы с похожими химическими свойствами. Наиболее важные свойства, учитываемые в периодической системе, включают металлические свойства, неметаллические свойства и свойства полупроводников.
Металлы занимают большую часть периодической таблицы. Они расположены слева от ступицы и стремятся от отрицательно заряженных электродов к положительно заряженным электродам в химических реакциях. Металлы обладают хорошей теплопроводностью, электропроводностью и гибкостью, а также образуют положительные ионы в растворах.
Неметаллы располагаются справа от ступицы в периодической таблице. Они обладают хорошей электроотрицательностью, а значит, образуют отрицательные ионы в растворах. Неметаллы обычно слабо кондуктивны и различаются посредственными химическими и физическими свойствами. Однако они играют важную роль в химических реакциях и в составе органических соединений.
Полупроводники, такие как кремний и германий, занимают область вдоль ступицы в периодической системе. Они обладают свойствами, промежуточными между металлами и неметаллами. Полупроводники проявляют полупроводимость и используются в электронной промышленности для создания транзисторов и других полупроводниковых устройств.
Металлы в главной подгруппе

Главная подгруппа периодической системы химических элементов включает в себя несколько групп металлов, которые имеют особые свойства и химическую реактивность.
В первой подгруппе главной группы находятся щелочные металлы: литий, натрий, калий, рубидий, цезий и франций. Они обладают высокой химической реактивностью, легко реагируют с водой, кислородом и другими веществами. Щелочные металлы широко используются в различных областях науки и промышленности, включая производство батарей, сплавов и лекарственных препаратов.
Во второй подгруппе главной группы располагаются щелочноземельные металлы: бериллий, магний, кальций, стронций, барий и радий. Щелочноземельные металлы также обладают хорошей реактивностью, но они менее реактивны, чем щелочные металлы первой подгруппы. Они широко применяются в промышленности, включая производство металлических сплавов, а также в медицине и сельском хозяйстве.
В третьей подгруппе главной группы находятся металлы, такие как алюминий, галлий, индий и таллий. Эти металлы обладают низкой плотностью и хорошей электропроводностью, что делает их полезными в промышленности и производстве электроники. Они также имеют некоторые специфические химические свойства, что позволяет использовать их в различных процессах и реакциях.
Металлы в побочных подгруппах
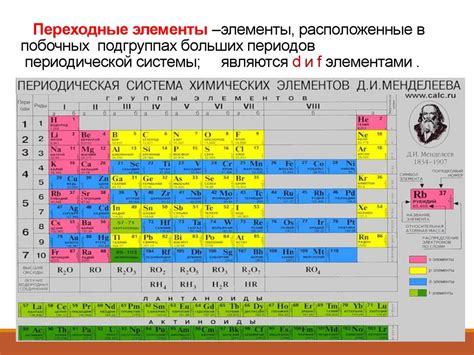
Побочные подгруппы элементов в периодической системе химических элементов содержат металлы различной природы. Одна из побочных подгрупп – это активные металлы щелочных земель (подгруппа 2A). В нее входят элементы магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы отличаются высокой активностью и обладают схожими химическими свойствами.
Еще одна побочная подгруппа – элементы бора (подгруппа 3A). Она включает в себя бор (B), алюминий (Al), галлий (Ga), индий (In) и таллий (Tl). Бор является неметаллом, но остальные элементы относятся к металлам. Алюминий – легкий и прочный металл, часто используется в строительстве и производстве упаковки. Галлий – металл, обладающий низкой температурой плавления и используемый в полупроводниковой промышленности. Индий и таллий также находят применение в электронике и медицине.
В побочной подгруппе почти вхождения – элементы углерода (подгруппа 4A). Сюда относятся углерод (C), кремний (Si), германий (Ge), олово (Sn) и свинец (Pb). Углерод – неметалл, но остальные элементы являются металлами. Кремний, германий и олово применяются в электронной промышленности, а свинец использовался ранее в производстве аккумуляторов и трубопроводов.
Вопрос-ответ

Какие металлы находятся на самом верху периодической системы химических элементов?
На самом верху периодической системы химических элементов находятся литий, натрий, калий и т.д. Это щелочные металлы, которые хорошо растворяются в воде и обладают высокой реакционной способностью.
Какие химические элементы называются переходными металлами и где они расположены в периодической системе?
Переходные металлы – это элементы, которые находятся в середине периодической системы химических элементов, между главными группами. Они имеют свойства, отличные от свойств щелочных и щелочноземельных металлов, например, разнообразие окислительных степеней.
Какие металлы находятся в конце периодической системы?
В конце периодической системы находятся позитроны и группа инертных газов или благородных газов, таких как неон, аргон и криптон. Эти элементы характеризуются стабильными электронными конфигурациями и низкой реакционной способностью из-за заполненных электронных оболочек.
