Металлы являются одной из основных групп химических элементов, обладающих высокой теплопроводностью, электропроводностью и механической прочностью. Благодаря своим уникальным свойствам, они нашли широкое применение в различных отраслях промышленности и повседневной жизни человека.
Металлы обладают способностью реагировать с другими элементами и соединениями, образуя разнообразные химические соединения. При реакции металлов с кислотами образуются соли и выделяется водород. Для более точного описания этих реакций используют уравнения реакций, которые отражают состав и структуру исходных веществ и продуктов.
Уравнения реакций между металлами и другими веществами позволяют определить не только взаимодействие между ними, но и их количественное соотношение. Они помогают ученым и инженерам понять особенности и характеристики реакций с металлами, что является важным при разработке новых материалов и технологий.
Изучение уравнений реакций с металлами имеет важное практическое значение и способствует развитию науки и технологии. Оно помогает понять процессы, происходящие с металлами в различных условиях, и применить эту информацию для создания новых материалов и улучшения существующих технологий.
Свойства металлов и их взаимодействие

Металлы – это химические элементы, которые обладают рядом характерных свойств. Одним из основных свойств металлов является их способность проводить электрический ток. Это объясняется наличием свободных электронов в зоне проводимости. Электрический ток в металлах передается от электронов к электронам, что обусловливает их высокую электропроводность.
Еще одним характерным свойством металлов является их блеск. Это связано с отражением света от поверхности металла, так как электроны в металлах могут свободно двигаться и рассеивать световые волны. Блеск металлов делает их привлекательными для использования в ювелирном деле и декоративных целях.
Металлы также обладают свойством пластичности и деформируемости. Они могут быть легко прокатаны в тонкие листы или вытянуты в проволоку без потери своих свойств. Это позволяет использовать металлы для изготовления различных конструкций и изделий.
Металлы активно взаимодействуют с другими элементами, образуя химические соединения. Реакции металлов с кислородом, галогенами и кислотами часто сопровождаются выделением тепла и образованием солей. Например, реакция железа с кислородом приводит к образованию ржавчины, а реакция меди с хлором приводит к образованию хлорида меди.
Реакции металлов с водой тоже хорошо известны. Некоторые металлы, такие как натрий и калий, реагируют очень активно, выделяясь водородом и образуя гидроксиды металлов. Другие металлы, такие как железо или цинк, не реагируют с водой при комнатной температуре, но могут растворяться в кислотах с образованием соответствующих солей и выделением водорода.
Физические свойства металлов
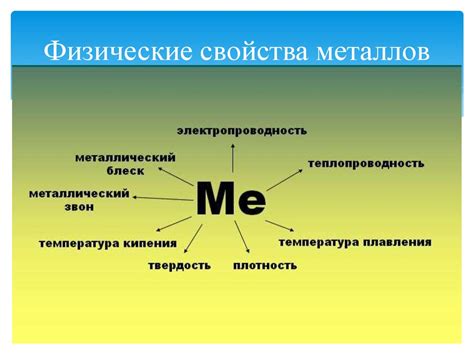
Металлы являются одной из основных групп химических элементов, имеющих ряд уникальных физических свойств.
Проводимость тепла и электричества. Одной из главных характеристик металлов является их высокая проводимость тепла и электричества. Это связано с наличием свободных электронов в структуре металлической решетки, которые легко передают тепловую и электрическую энергию.
Пластичность и формоизменяемость. Металлы обладают высокой пластичностью, что позволяет их легко подвергать деформации и обработке при нагреве. Они могут быть раскатаны, прокатаны, вытянуты в тонкие проволоки или расплавлены и отлиты в разные формы.
Блеск и отражательная способность. Большинство металлов обладают блеском, называемым металлическим блеском. Это связано с их способностью отражать свет. Благодаря этому свойству металлы широко используются в производстве зеркал, отражающих поверхностей и других изделий, где необходимо отражение света.
Тугоплавкость и высокая плотность. Большинство металлов имеют высокую температуру плавления, поэтому они часто используются в различных отраслях промышленности, где требуется высокая температура работы. Также металлы обладают высокой плотностью, что делает их тяжелыми и прочными материалами.
Магнитные свойства. Некоторые металлы обладают магнитными свойствами. Например, железо, никель и кобальт являются магнитными металлами. Эти свойства металлов широко используются в производстве электромагнитов, магнитов и других устройств, где требуется магнитное взаимодействие.
Использование металлов в различных отраслях. Из-за своих уникальных физических свойств, металлы играют важную роль в различных отраслях промышленности, строительстве и науке. Они используются в производстве автомобилей, самолетов, электроники, оружия, зданий и других изделий, где требуются прочность, пластичность, проводимость и другие свойства металлов.
Химические свойства металлов

Металлы обладают рядом характерных химических свойств. Они активно взаимодействуют с другими веществами и способны образовывать различные соединения.
Металлы обычно обладают высокой активностью и хорошей электропроводностью. Они способны образовывать положительные ионы, отдавая свои электроны. Это делает металлы хорошими реагентами в химических реакциях.
Металлы обычно реагируют с кислотами, образуя соли и выделяя водород. Например, железо реагирует с кислородом воздуха, образуя ржавчину, что приводит к коррозии металла.
Некоторые металлы, такие как алюминий и цинк, обладают способностью образовывать пассивные оксидные пленки на своей поверхности, которые защищают металл от дальнейшей коррозии.
Металлы также могут реагировать с неметаллами. Например, реакция металла с кислородом приводит к образованию оксида металла.
Кроме того, металлы могут реагировать с водой, выделяя водород. Например, натрий активно реагирует с водой, что сопровождается появлением пузырьков водорода и образованием щелочного раствора.
Уравнения реакций металлов с кислотами
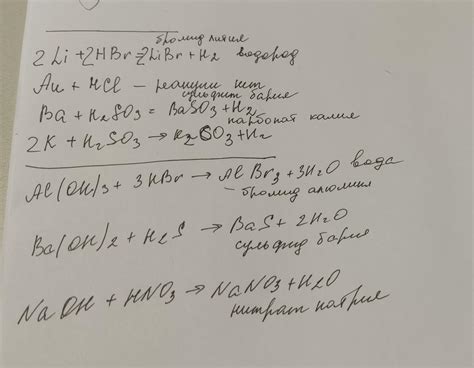
Реакция металлов с кислотами является одной из основных химических реакций, которая приводит к образованию солей металлов и выделению водорода. Уравнения реакций позволяют описать химическую превращение металлов при взаимодействии с различными видами кислот.
Для уравнения реакции металлов с кислотами необходимо учесть ионообмен, который приводит к образованию соли и выделению водорода. Например, реакция цинка с соляной кислотой образует хлорид цинка и выделяет водород:
Zn + 2HCl → ZnCl2 + H2
Другим примером может быть реакция железа с серной кислотой, при которой образуется сульфат железа и выделяется водород:
Fe + H2SO4 → FeSO4 + H2
Реакция металлов с кислотами может быть использована для получения солей металлов. Например, реакция меди с азотной кислотой приводит к образованию нитрата меди:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Описанные реакции позволяют понять, как металлы взаимодействуют с кислотами и какие вещества образуются в результате. Уравнения реакций металлов с кислотами играют важную роль в изучении химических свойств металлов и их применении в различных отраслях промышленности.
Уравнения реакций металлов с неметаллами
Металлы и неметаллы образуют различные соединения в химических реакциях. При взаимодействии металлов с неметаллами обычно происходят окислительно-восстановительные реакции, при которых металл отдает электроны неметаллу.
Одной из наиболее распространенных реакций металлов с неметаллами является реакция металла с кислородом. Например, реакция железа с кислородом приводит к образованию оксида железа:
4Fe + 3O2 → 2Fe2O3
Алюминий взаимодействует с кислородом, образуя оксид алюминия:
4Al + 3O2 → 2Al2O3
Реакции металлов с халогенами также являются типичными примерами реакций металлов с неметаллами. Например, реакция натрия с хлором приводит к образованию хлорида натрия:
2Na + Cl2 → 2NaCl
Реакция кальция с бромом приводит к образованию бромида кальция:
Ca + Br2 → CaBr2
В реакциях металлов с неметаллами важно правильно сбалансировать уравнения реакций и учесть заряды атомов, чтобы сформулировать корректное химическое уравнение для данной реакции.
Уравнения реакций металлов с кислородом
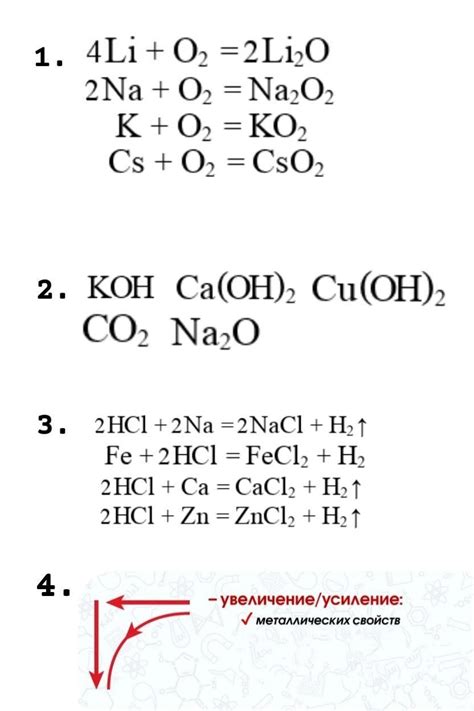
Реакции металлов с кислородом являются одним из важных процессов, происходящих в химии. Они приводят к образованию оксидов металлов. Распространенными примерами таких реакций являются горение металлов в присутствии кислорода из воздуха.
Уравнения реакций металлов с кислородом можно записать в общем виде следующим образом:
- 2M + O2 → 2MO, где M — символ металла, а MO — оксид металла
Например, реакция горения железа с кислородом можно записать так:
- 4Fe + 3O2 → 2Fe2O3
В результате реакции образуется оксид железа (Fe2O3), который является твердым веществом с красно-коричневым цветом.
Реакции металлов с кислородом обладают высокой эндотермической реакцией, то есть сопровождаются выделением большого количества тепла. Это объясняет яркое пламя и высокую температуру при горении некоторых металлов, например, магния или алюминия.
Знание уравнений реакций металлов с кислородом позволяет предсказать и объяснить множество химических процессов в естественных и промышленных системах. Особое значение эти реакции имеют в области металлургии и производства различных металлических изделий.
Уравнения реакций металлов с водой

Металлы могут реагировать с водой, образуя гидроксиды и выделяя водород. Эти реакции являются основными примерами того, как металлы взаимодействуют с водой. Результаты таких реакций могут быть использованы для определения некоторых металлов или для получения водорода.
Уравнение реакции металла с водой обычно записывается в виде:
Металл + вода → гидроксид металла + водород
Например, уравнение реакции натрия с водой будет выглядеть следующим образом:
2Na + 2H2O → 2NaOH + H2
В результате такой реакции образует натриевый гидроксид и выделяется молекула водорода.
Однако не все металлы реагируют с водой в равной степени. Некоторые металлы, такие как натрий и калий, активно взаимодействуют с водой, выделяя большое количество водорода и образуя большое количество гидроксида металла. Другие металлы, например, железо или медь, реагируют с водой медленно или вовсе не реагируют.
Эти реакции могут быть использованы как метод определения некоторых металлов. Реакция с водой может быть тестовым критерием для идентификации металла или его сплава. Кроме того, металлы, реагирующие с водой, могут использоваться для получения водорода – важного химического элемента, который имеет широкий спектр применений в промышленности и научных исследованиях.
Уравнения реакций металлов с солями

Металлы часто вступают в химические реакции с солями, образуя новые вещества. Эти реакции могут быть полные или неполные в зависимости от условий и свойств металла и соли.
В реакциях металлов с солями обычно происходит обмен ионами. Металл может вытеснить другой металл из его соли или образовать соль с новым ионом. Например, железо, реагируя с раствором медного купрата, вытесняет медь из раствора и образует соль железа. Уравнение этой реакции можно записать следующим образом:
Fe + CuSO4 → FeSO4 + Cu
В других случаях металл может образовать соль с новым ионом. Например, магний, реагируя с раствором серной кислоты, образует соль магния и выделяется водород. Уравнение этой реакции можно записать следующим образом:
Mg + H2SO4 → MgSO4 + H2
В некоторых реакциях металлы могут реагировать с солью только при нагревании или в присутствии катализатора. Например, алюминий может реагировать с раствором хлорида меди при нагревании и образовать соль алюминия и медь. Уравнение этой реакции можно записать следующим образом:
2Al + 3CuCl2 → 2AlCl3 + 3Cu
Важно отметить, что уравнения реакций металлов с солями являются упрощенными и не учитывают влияние таких факторов, как концентрация раствора или температура. Кроме того, реакция между металлом и солью может протекать только при определенном pH или в определенной среде.
Таким образом, уравнения реакций металлов с солями позволяют нам лучше понять химические свойства металлов и их возможные реакции с другими веществами. Это важное знание в области химии, которое может применяться при решении различных практических задач.
Вопрос-ответ

Какие металлы реагируют с кислородом?
Многие металлы реагируют с кислородом, образуя оксиды металлов. Некоторые из них, такие как железо, алюминий и медь, реагируют с кислородом воздуха при повышенной температуре, образуя ржавчину, оксид алюминия и оксид меди соответственно.
Как образуются соли металлов?
Соли металлов образуются путем реакции металлов с кислотами. В результате реакции происходит замещение водорода металлом, что приводит к образованию ионов металла в растворе. Например, реакция хлороводородной кислоты с цинком приводит к образованию хлорида цинка: Zn + 2HCl → ZnCl2 + H2.
Что такое гальваническая реакция?
Гальваническая реакция - это реакция, в результате которой происходит преобразование химической энергии в электрическую. Она осуществляется при потенциальной разности между двумя электродами, имеющими различные потенциалы. Примером гальванической реакции является реакция между медным и цинковым электродами в растворе соли меди и цинка.
Почему некоторые металлы реагируют с кислотами, а некоторые нет?
Реакция металлов с кислотами зависит от активности металла. Активные металлы, такие как натрий и калий, реагируют с кислотами, вытесняя из них водород. Менее активные металлы, такие как медь и серебро, не реагируют с кислотами и не вытесняют водород. Это связано с различием в их химических свойствах и реакционной способности.
