Взаимодействие металлов средней активности с водой представляет собой одно из важнейших явлений в химии. Данный процесс имеет большое значение как в промышленности, так и в науке. От знания условий и механизма таких реакций зависит возможность применения определенных металлов в различных целях.
Условия реакции металлов средней активности с водой различны и зависят от конкретных факторов. Одним из наиболее важных условий является наличие воды в достаточном количестве. Кроме того, влияние на протекание реакции оказывает температура окружающей среды. Например, при повышенной температуре активация металла происходит быстрее.
Механизм реакции металлов средней активности с водой является достаточно сложным процессом, включающим несколько стадий. Сначала происходит образование активных ионов металла, которые реагируют с молекулами воды, образуя гидроксиды металлов и выделяя гидроген. Далее, в зависимости от условий, включаются различные дополнительные реакции, которые могут приводить к образованию оксидов или других соединений металлов.
Изучение реакции металлов средней активности с водой имеет большое значение в научных исследованиях, направленных на развитие новых материалов с определенными свойствами. Также данная информация находит применение в различных технологических процессах, где необходимы реакции с участием металлов средней активности.
Металлы средней активности

Металлы средней активности – это класс металлов, которые проявляют среднюю реакционность при взаимодействии с водой. Они находятся между металлами высокой активности, которые реагируют с водой с большим выделением энергии, и металлами низкой активности, которые не растворяются в воде и не реагируют с ней.
Перечень металлов средней активности включает такие элементы, как железо, цинк, алюминий, магний и др. Они обладают особенностями взаимодействия с водой, которые определяются по преимущественному образованию соответствующих оксидов или гидроксидов.
Металлы средней активности обычно реагируют с водой при нагревании или при наличии взаимодействующих катализаторов. Реакция может протекать с различной скоростью и может сопровождаться выделением водорода или образованием осадка оксидов или гидроксидов металлов.
Взаимодействие металлов средней активности с водой имеет широкую практическую значимость. Эти металлы активно используются в различных отраслях промышленности, включая производство металлоконструкций, автомобилей, электроники и многих других сфер. Изучение механизмов реакции металлов с водой позволяет оптимизировать и развивать процессы и технологии, связанные с использованием данных металлов.
Вода как реактив

Вода является одним из наиболее широко используемых реагентов при изучении реакции металлов средней активности. Она обладает уникальными свойствами, которые позволяют ей взаимодействовать с многими металлами и формировать различные соединения.
Реакция металлов с водой зависит от их активности. Некоторые металлы, такие как натрий и калий, реагируют с водой очень быстро и энергично. При контакте с водой они мгновенно образуют гидроксиды и выделяют большое количество водорода. Это происходит из-за того, что они имеют низкую энергию ионизации и легко отдают свои электроны.
Другие металлы, такие как магний и алюминий, реагируют с водой, но гораздо медленнее. Они выделяют гидроксиды и водород, но процесс идет более плавно и не так энергично. Это связано с их более высокой активностью ионизации и большей степенью прочности связей между атомами.
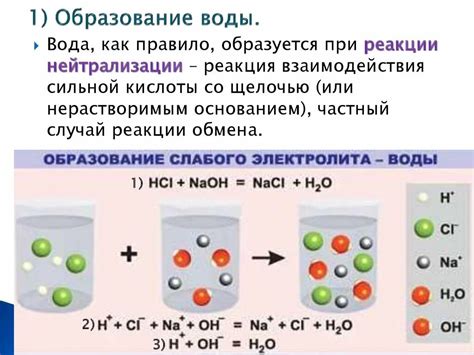
Реакция металлов с водой может быть описана следующим механизмом. Сначала металл взаимодействует с водой, отдавая свои электроны и образуя положительные ионы металла и отрицательные ионы гидроксида. Затем ионы металла реагируют с водородными ионами, образуя водород и гидроксидные соединения. Таким образом, реакция металлов с водой приводит к образованию гидроксида металла и выделению водорода.
Изучение реакции металлов с водой имеет не только академическое значение, но и огромную практическую важность. Многие металлы используются в различных отраслях промышленности и технологии, и знание их химической активности позволяет более эффективно использовать их свойства.
Условия реакции

Реакция металлов средней активности с водой происходит при определенных условиях. Во-первых, необходимо наличие воды для начала реакции. Вода является реактивом, с которым вступают взаимодействие металлы.
Во-вторых, реакция может происходить при определенной температуре. Обычно для реакции среднереактивных металлов с водой достаточно комнатной температуры. Однако для некоторых металлов, таких как натрий и калий, необходимо нагревание воды для начала реакции.
В-третьих, реакция происходит в атмосфере воздуха. Вода, используемая в реакции, должна находиться под воздействием кислорода, так как это одно из условий для окисления металла.
Кроме того, реакция металлов с водой происходит при наличии катализаторов. Например, гидроксид ион является катализатором для реакции алюминия с водой. Катализаторы ускоряют химическую реакцию, позволяя ей происходить при более низкой температуре или воздействии меньшего количества реактивов.
Температура и давление

Температура и давление играют важную роль в реакции металлов средней активности с водой. Они влияют на скорость и интенсивность реакции, а также на образование газовых продуктов.
Повышение температуры воды увеличивает скорость реакции металла с водой. При нагревании воды, частицы металла приобретают большую энергию и могут более активно сталкиваться с молекулами воды, что способствует разрушению химических связей воды и образованию газовых продуктов. Однако, некоторые металлы, такие как цинк и железо, могут вступать в реакцию с водой только при нагревании.
Давление также может влиять на реакцию металла с водой. Увеличение давления может увеличить скорость реакции, так как большее количество молекул воды будет взаимодействовать с металлической поверхностью. Но давление воздуха не является основным фактором, влияющим на реакцию металлов средней активности с водой, поскольку эта реакция происходит в наиболее обычных условиях давления воздуха.
Чистота воды

Чистота воды является важным фактором при реакции металлов средней активности с водой. Вода должна быть чистой, чтобы результаты эксперимента были достоверными. Загрязнения в воде могут повлиять на скорость реакции и образование осадка, что может исказить результаты эксперимента.
Для обеспечения чистоты воды используются различные методы очистки, такие как фильтрация и дистилляция. Фильтрация позволяет удалить крупные загрязнения, такие как песок и грязь, а дистилляция позволяет удалить микроорганизмы, минералы и другие мелкие загрязнения.
Фильтрация осуществляется с помощью специальных фильтров, которые улавливают крупные частицы и позволяют чистой воде пройти через них. Это позволяет удалить механические загрязнения и улучшить качество воды.
Дистилляция - процесс, в ходе которого вода нагревается до кипения, а затем пар конденсируется и собирается в отдельную ёмкость. При дистилляции удаляются большинство загрязнений, включая микроорганизмы и минералы. Это обеспечивает высокую степень очистки воды.
Чистота воды является важным аспектом при проведении экспериментов с реакцией металлов средней активности с водой. Обеспечивая чистоту воды, мы добиваемся точности в получении результатов и достоверности эксперимента.
Механизм реакции

Реакция металлов средней активности с водой осуществляется по механизму окислительно-восстановительных реакций. Процесс начинается с извлечения гидроксидного ионa (OH-) из воды. Для этого металл должен обладать достаточной активностью. Такие металлы, как магний (Mg), алюминий (Al) и цинк (Zn) способны реагировать с водой.
При взаимодействии металла с водой происходит окисление металла и одновременно восстановление воды. Металл отдает свои электроны молекулам воды, которые в результате ионизируются, образуя ионы гидроксида и водорода. Реакция выглядит следующим образом:
M + H2O → M(OH)2 + H2↑
При этом, образовавшийся гидроксидный ион (OH-) реагирует с избыточным водородным ионом (H+), образуя воду. Таким образом, происходит регенерация воды и образование гидроксида металла. Уравнение реакции может быть записано следующим образом:
M(OH)2 + 2H+ → M(OH)2 + 2H2O
Механизм реакции металлов средней активности с водой включает в себя окисление металла и одновременное восстановление воды, образование гидроксида металла и выделение водорода. Этот процесс является спонтанным, так как металлы имеют большую аффинность кислорода, чем к водороду. Такие реакции обладают важным практическим значением и применяются в различных отраслях промышленности.
Реакция разложения воды
Реакция разложения воды представляет собой процесс, при котором молекула воды распадается на атомы водорода (Н) и кислорода (О). Данная реакция является важным физико-химическим процессом, который происходит при наличии достаточного количества энергии.
Реакция разложения воды может происходить как спонтанно, так и под воздействием различных факторов. Одним из наиболее известных способов вызвать данную реакцию является применение электрического тока. При прохождении постоянного электрического тока через воду, происходит электролиз, в результате чего молекула воды расщепляется на ионы водорода и кислорода.
Реакция разложения воды обусловлена наличием полярных связей между атомами водорода и атомами кислорода в молекуле воды. Поляризованные соединения разлагаются легче, так как их связи слабее и требуется меньшая энергия для их разрыва.
Реакция разложения воды имеет важное практическое значение и используется в различных областях, например, в процессе получения водорода, который может быть использован как источник энергии. Кроме того, данная реакция играет важную роль в биохимических процессах, включая фотосинтез растений.
Связывание водорода и металла
Связывание водорода и металла – это химический процесс, в результате которого между атомами металла и молекулами водорода образуются новые химические связи. Этот процесс является одной из стадий реакции металлов средней активности с водой.
В реакции водорода с металлом атомы металла могут притягивать электроны от молекул водорода, образуя ион металла с положительным зарядом и отрицательно заряженными водородными ионами. Это связывание водорода с металлом может иметь фундаментальное значение, поскольку это является первым шагом в образовании металлической связи.
Взаимодействие водорода и металла может приводить к образованию водородных соединений, таких как гидриды, которые могут обладать различными физическими и химическими свойствами. Например, некоторые гидриды обладают высокой электропроводностью и используются в различных электронных устройствах, а другие могут быть использованы в качестве хранителей водорода для различных промышленных процессов.
Вопрос-ответ

Какие металлы средней активности взаимодействуют с водой?
Металлы средней активности, такие как цинк, железо или алюминий, могут реагировать с водой.
Почему металлы средней активности реагируют с водой?
Металлы средней активности обладают достаточной активностью, чтобы вытеснить водород из молекулы воды, но не настолько активны, чтобы автоматически взаимодействовать с ней, как активные металлы натрий или калий.
Каковы условия реакции металлов средней активности с водой?
Для реакции металлов средней активности с водой требуется наличие катализатора, например кислородиона. Также важным условием является наличие воды в жидкой или газообразной фазе, поскольку активация металла происходит на ее поверхности.
Чем отличается реакция металлов средней активности с водой от реакции активных металлов?
В отличие от реакции активных металлов, реакция металлов средней активности с водой происходит медленнее и требует наличия катализатора. Также, в отличие от активных металлов, металлы средней активности могут образовывать оксиды или гидроксиды в процессе реакции.
Каков механизм реакции металлов средней активности с водой?
Механизм реакции металлов средней активности с водой заключается в взаимодействии металла с катализатором (например, кислородионом) в присутствии воды. В результате образуется оксид металла и выделяется водород.
