Металлы являются одним из основных классов химических элементов, обладающих высокой электропроводностью и теплопроводностью. Они широко используются в различных отраслях промышленности и являются неотъемлемой частью повседневной жизни. Для получения металлов часто применяются различные химические реакции и способы.
Существует несколько типов химических реакций, которые позволяют получать металлы. Одним из самых распространенных способов получения металлов является восстановление их окислов редуцирующими агентами. Например, реакция восстановления железа из его оксида происходит при нагревании оксида железа с углеродом или водородом.
Другим способом получения металлов является использование электролитического метода. Этот метод основан на проведении электрического тока через электролит, содержащий ионы металла. При этом положительно заряженные ионы металла притягиваются к отрицательно заряженному электроду, где они застывают в виде чистого металла.
В некоторых случаях металлы можно получить путем гидролиза солей металлов. Гидролиз - это химическая реакция, при которой соль разлагается на кислоту и основание. Если основание является слабой щелочью, то образуется осадок металлического гидроксида, который можно отделить и превратить в чистый металл.
Металлы: реакции и получение
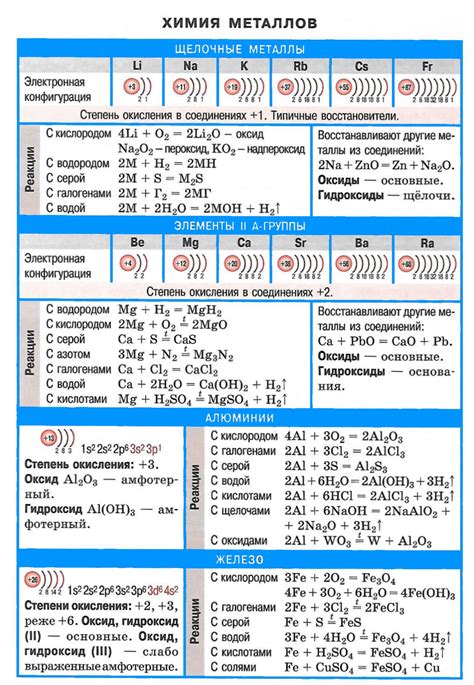
Металлы — это группа химических элементов, обладающих характерными физическими и химическими свойствами. Они образуют множество реакций с различными веществами, что делает их важными объектами изучения в химии.
Реакции металлов проявляются во взаимодействии с кислотами, основаниями, солями и другими веществами. Например, металлы активно реагируют с кислородом воздуха, образуя оксиды. Реакции с водой также весьма распространены: некоторые металлы реагируют с водой с выделением водорода или образованием гидроксидов.
Металлы можно получить различными способами. Один из них – электролиз, при котором происходит разложение вещества под действием электрического тока. Например, алюминий, кальций и другие металлы получают из своих оксидов или хлоридов, применяя электролиз.
Оксиды металлов могут быть получены также при термической обработке металла. Так, нагревая железо в воздухе, образуется железо(III)оксид. Другой способ получения металлов – химическое восстановление. Например, цинк можно получить, восстановив цинковую соль при помощи металлов, электронейтральнее него.
- Еще одним способом получения металлов является использование минеральных руд. Однако для этого необходимы сложные технические процессы и большие энергозатраты.
- При получении некоторых металлов
- используется пирометаллургический метод - технологический процесс нагрева и последующего охлаждения
- цинк, алюминий, магний
- известны как расплавные процессы
| Металл | Способ получения | Применение |
|---|---|---|
| Железо | Доменный метод | Производство стали |
| Медь | Флотационная концентрация | Производство проводников и монет |
| Алюминий | Байеровский процесс | Производство авиационных конструкций, упаковки и прочих изделий |
Таким образом, металлы являются важными элементами химического мира. Их реакции и способы получения представляют интерес для науки и промышленности, и они находят широкое применение в различных сферах человеческой деятельности.
Свойства и состояния металлов
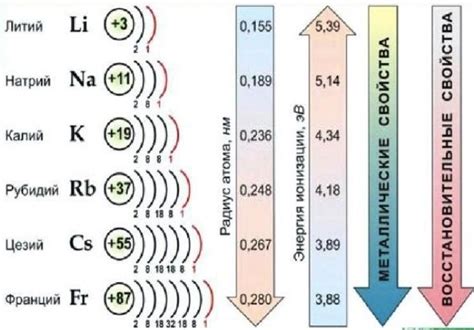
Металлы - это группа элементов, обладающих рядом характерных свойств, которые отличают их от других веществ. Одним из основных свойств металлов является их высокая тепло- и электропроводность. Это объясняется особенностями строения и взаимодействия металлической решетки.
В состоянии твердого тела металлы обычно имеют блестящую поверхность, называемую металлическим блеском. Они хорошо отливают свет и способны отражать электромагнитные волны разных длин, что делает их прекрасными материалами для зеркал и отражателей.
Один из важных физических параметров металлов - пластичность, то есть способность менять свою форму без разрушения. Благодаря этому свойству металлы легко поддаются обработке и позволяют создавать различные изделия и сооружения.
Металлы имеют высокую плотность, что позволяет им быть тяжелыми материалами. Они также отличаются высокой температурой плавления и кипения, что делает их полезными для изготовления инструментов, металлических конструкций и других прочных материалов.
Изменение внешних условий, таких как температура и давление, может привести к изменению свойств металлов. Например, некоторые металлы при понижении температуры становятся хрупкими и могут легко разрушаться, в то время как другие металлы могут сохранять свою пластичность и прочность даже при очень низких температурах.
Химические реакции металлов
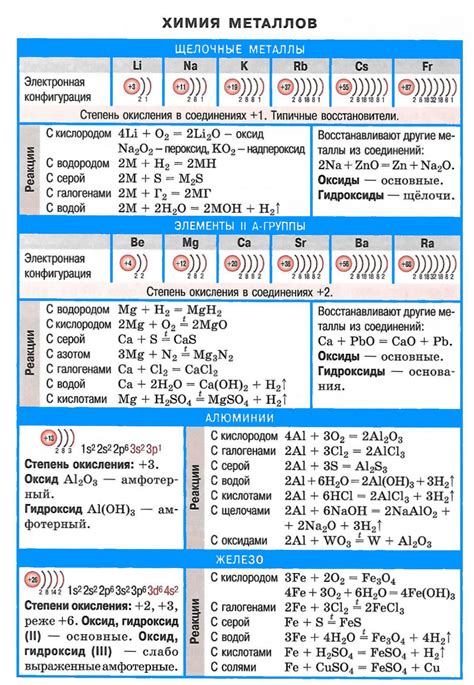
Металлы являются одной из основных групп веществ, способных к химическим реакциям. Они обладают способностью образовывать ионы положительного заряда (катионы) при взаимодействии с различными веществами.
Реакции металлов с кислотами являются одним из наиболее известных примеров химических реакций данного класса веществ. Металлы, будучи активными элементами, могут замещать водород из кислоты, образуя соли и выделяя водородный газ. Например, реакция железа с соляной кислотой приводит к образованию хлорида железа и выделению водорода:
Fe + 2HCl → FeCl2 + H2
Реакции металлов с кислородом тоже хорошо известны. Металлы, способные легко окисляться, образуют оксиды при взаимодействии с кислородом. Например, реакция магния с кислородом приводит к образованию оксида магния:
2Mg + O2 → 2MgO
Также металлы способны реагировать с веществами, которые представляют собой электролиты, например, солями. В данном случае происходит обмен ионами между металлом и солью, в результате чего образуются новые соединения. Например, реакция цинка с серной кислотой приводит к образованию цинка сульфата:
Zn + H2SO4 → ZnSO4 + H2
Такие химические реакции металлов являются фундаментальными и широко применяются в различных областях химии и промышленности.
Реакции с кислородом и водой

Металлы активно взаимодействуют с кислородом и водой, приводя к образованию оксидов и гидроксидов. При реакции с кислородом металлы окисляются, теряют электроны и образуют оксиды. Например, медь реагирует с кислородом воздуха, образуя черную корку оксида меди. Реакции с кислородом могут протекать самопроизвольно или при нагревании металла.
Вода также активно взаимодействует с металлами, приводя к образованию гидроксидов и выделению водорода. Эта реакция особенно хорошо проявляется на примере щелочных металлов, таких как натрий и калий. При контакте с водой эти металлы быстро реагируют, выделяя водород и образуя гидроксиды. Натрий, например, реагирует с водой с выделением горячего водорода и образованием гидроксида натрия. Реакции с водой обычно протекают быстро и сопровождаются выделением тепла и пламени.
- Некоторые металлы, такие как натрий и калий, реагируют с водой самопроизвольно, причем реакция протекает так быстро, что может сопровождаться выбросом образовавшегося водорода в виде искр
- Другие металлы, например, алюминий, реагируют с водой только с активацией, то есть сначала необходимо нанести на поверхность металла некоторый предварительный удар или разбить оксидную пленку, образовавшуюся на поверхности воздуха
Реакции металлов с кислородом и водой являются важными с точки зрения получения металлических оксидов и гидроксидов, которые широко используются в промышленности и научных исследованиях. Эти реакции также демонстрируют химическую активность металлов и позволяют изучать их свойства и поведение в различных условиях.
Способы получения металлов
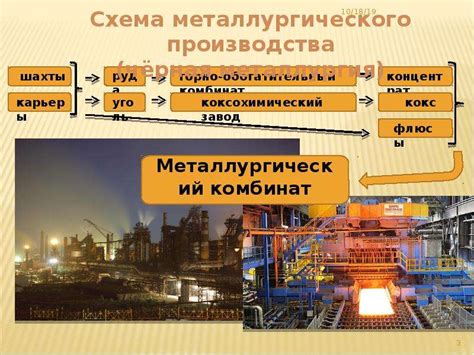
Металлы - это химические элементы, обладающие характерными физическими и химическими свойствами, которые делают их полезными для различных промышленных и технических целей. Существует несколько способов получения металлов, включая термические методы, химические реакции и электролиз.
Один из самых распространенных способов получения металлов - это извлечение их из руд. Он включает в себя такие этапы, как дробление и помол руды, обогащение металла и окончательное извлечение из руды. Эта техника основывается на физических свойствах металла и его соединений.
Некоторые металлы могут быть получены при помощи химических реакций. Например, алюминий может быть получен из алюминия кислотой, окислением алюминия водородом или алюминия воздухом. Этот способ получения металлов обычно требует определенных реагентов и контроля условий реакции.
Термические методы получения металлов включают в себя использование высокой температуры для разложения металлических соединений. Например, железо может быть получено путем обжига железной руды при высокой температуре. Этот процесс требует специального оборудования и контроля температурных условий.
Также существует метод получения металлов, основанный на электролизе. В этом случае, металл растворяется в электролите, а затем выделяется на электроде. Например, медь может быть получена путем электролиза раствора медных соединений. Этот метод требует электрической энергии и специального оборудования.
Кроме того, некоторые металлы могут быть получены путем восстановления из их солей или использования других специализированных техник. Например, золото может быть получено путем восстановления из золотых солей или использования химических процессов, таких как цианирование.
Все эти способы получения металлов имеют свои преимущества и недостатки и могут применяться в различных областях промышленности и научных исследований. Выбор метода зависит от типа металла, требований процесса и доступных ресурсов.
Электролиз и термическое восстановление

Электролиз и термическое восстановление являются двумя основными способами получения металлов. Оба метода основаны на использовании химических реакций для разложения соединений металлов и получения чистого металла.
Электролиз использует электрическую энергию для разложения соединений металлов. Во время электролиза, металлы находятся в растворе или расплаве и пролегают через электроды, которые подключены к источнику постоянного тока. При прохождении тока металлы окисляются в ионы и перемещаются к катоду, где восстанавливаются обратно в чистый металл. Процесс электролиза позволяет получить высокочистые металлы с высокой степенью чистоты.
Термическое восстановление основано на использовании высоких температур для разложения соединений металлов. При этом методе, соединения металлов нагреваются до очень высокой температуры, при которой происходит разложение и выделение металлического вещества. Термическое восстановление широко используется для получения металлов, таких как железо, алюминий и магний, и позволяет получить металлы с высокой степенью чистоты, хотя не такую высокую, как при электролизе.
В заключение, как электролиз, так и термическое восстановление представляют собой эффективные методы получения металлов. Выбор метода зависит от свойств и требований конкретного металла. Электролиз позволяет получить металлы с очень высокой степенью чистоты, в то время как термическое восстановление обеспечивает более высокую производительность и меньшие энергозатраты.
Вопрос-ответ

Какие способы получения металлов существуют?
Металлы можно получать различными способами, включая высокотемпературное восстановление оксидов, электролиз, химическое осаждение и гидрометаллургические методы.
Какие металлы встречаются в природе в свободном виде?
В природе в свободном виде встречаются такие металлы, как золото, серебро и платина.
Какие уравнения реакций используются при получении металлов?
Уравнения реакций, используемые при получении металлов, зависят от способа получения. Например, при высокотемпературном восстановлении оксидов металла используется уравнение реакции восстановления.
Каким образом можно получить металлы электролизом?
Металлы могут быть получены электролизом путем погружения металлического катода и анода в раствор электролита, после чего при подаче электрического тока происходит электродные реакции и осаждение металла на катоде.
