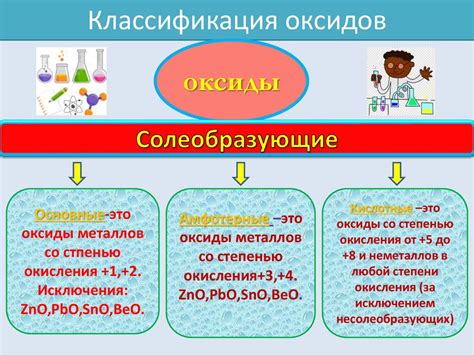
Оксиды металлов с различными степенями окисления играют важную роль в химии и многих других науках. Они представляют собой соединения металлов с кислородом и могут иметь различные свойства и химические реакции.
Металлы со степенью окисления 1 и 2 могут образовывать различные оксиды. Оксиды металлов со степенью окисления 1, например, обычно являются основаниями и могут реагировать с кислотами, образуя соли и воду. Они также могут обладать каталитической активностью и использоваться в различных химических реакциях.
Оксиды металлов со степенью окисления 2, в свою очередь, обычно являются оксидами и могут реагировать с кислородом или водой. Они широко используются в промышленности, в том числе в производстве керамики, электроники и катализаторов.
Научные исследования оксидов металлов с различными степенями окисления являются активной областью исследований и имеют большое значение для практического применения данных соединений. Понимание их свойств и химических реакций позволяет улучшить процессы производства и обработки различных материалов.
Роль оксидов металлами со степенями окисления 1 и 2

Оксиды металлов со степенями окисления 1 и 2 играют важную роль в химии и имеют множество применений. Эти соединения являются не только химическими соединениями, но и имеют определенные свойства и функции.
Во-первых, оксиды металлов со степенями окисления 1 и 2 используются в промышленности в качестве катализаторов. Они способны ускорять химические реакции и обеспечивать высокую эффективность процессов, таких как окисление алкоголей или восстановление органических соединений.
Во-вторых, оксиды таких металлов как медь, железо и алюминий, используются в производстве различных материалов. Например, оксид железа (III) используется для получения магнитных материалов, а оксид алюминия (алюминий оксид) применяется в качестве добавки в цемент для улучшения механических свойств.
В-третьих, некоторые оксиды металлов используются в медицине. Например, оксид цинка широко применяется в качестве антисептика и противовоспалительного средства, а оксид магния используется в составе лекарственных препаратов для нормализации работы пищеварительной системы.
И наконец, оксиды металлов со степенями окисления 1 и 2 играют важную роль в химическом образовании. Они являются основными компонентами многих неорганических соединений и солей. Благодаря своим свойствам и степеням окисления, они обладают уникальными свойствами и способствуют формированию сложных и стабильных химических соединений.
В целом, оксиды металлов со степенями окисления 1 и 2 играют важную роль в различных областях научных и промышленных исследований. Они используются в химическом производстве, материаловедении, медицине и активно исследуются учеными в контексте создания новых соединений и материалов с улучшенными свойствами.
Важность и применение оксидов со степенью окисления 1
Оксиды со степенью окисления 1 имеют большую важность и находят широкое применение в различных областях жизни. Они являются основными компонентами многих веществ и материалов, которые используются в различных отраслях промышленности и научных исследований.
Один из примеров оксидов со степенью окисления 1 - оксид натрия (Na₂O). Этот соединение широко применяется в стекольной промышленности для производства стекла, а также в производстве мыла и моющих средств. Оксид натрия также используется в химической промышленности для производства других важных химических соединений.
Оксиды со степенью окисления 1 также имеют значение в биологии и медицине. Например, оксид фосфора (P₂O) является важным компонентом ДНК и РНК, которые являются основными носителями генетической информации. Оксид фосфора также используется в фармацевтической промышленности для производства лекарственных препаратов.
Еще один пример оксида со степенью окисления 1 - оксид железа (FeO). Этот оксид широко используется в производстве железных и стальных изделий. Оксид железа также играет важную роль в жизни растений, так как он является необходимым компонентом для образования хлорофилла, который отвечает за процесс фотосинтеза.
В целом, оксиды со степенью окисления 1 являются важными веществами с широким спектром применений. Они играют ключевую роль в различных областях и приносят пользу человечеству. Понимание и изучение их свойств и применений имеют большое значение для развития науки и технологий.
Роль и свойства оксидов со степенью окисления 2
Роль оксидов со степенью окисления 2 в химических реакциях
Оксиды со степенью окисления 2 являются одним из наиболее распространенных классов химических соединений металлов. Они играют важную роль в различных процессах, включая образование солей, реакции окисления-восстановления и промышленные процессы.
Оксиды со степенью окисления 2 обладают уникальными свойствами, которые делают их ценными веществами в химической промышленности. Одно из наиболее известных свойств таких оксидов - способность реагировать с кислородом или другими веществами, что позволяет им участвовать в процессах горения, синтеза и окисления.
Физические свойства оксидов со степенью окисления 2
Оксиды со степенью окисления 2 обычно являются твердыми веществами с высокими точками плавления и кипения. Они могут быть как ионными соединениями, так и молекулярными веществами. Некоторые оксиды со степенью окисления 2 обладают полупроводниковыми свойствами и находят применение в электронике.
Оксиды со степенью окисления 2 могут иметь различные цвета - от белого и безцветного до черного, синего или зеленого. Это связано с наличием или отсутствием переходных металлов и разными электронными состояниями их ионов в соединении.
Примеры оксидов со степенью окисления 2
Примерами оксидов со степенью окисления 2 являются оксиды металлов, таких как оксид железа (FeO), оксид магния (MgO), оксид цинка (ZnO) и оксид алюминия (Al2O3). Эти соединения широко используются в различных отраслях промышленности, включая производство стекла, керамики, лакокрасочных материалов и многих других.
Оксиды со степенью окисления 2 имеют важное значение в химической науке и промышленности. Их свойства и реакционная способность делают их незаменимыми компонентами многих процессов и материалов. Изучение этих соединений позволяет расширить наши знания в области химии и применить их в создании новых технологий и материалов.
Образование оксидов со степенью окисления 1

Оксиды со степенью окисления 1 образуются металлами, у которых только одна валентность, то есть металлами с однозарядными ионами. Примерами таких металлов являются натрий, калий, литий и другие щелочные металлы.
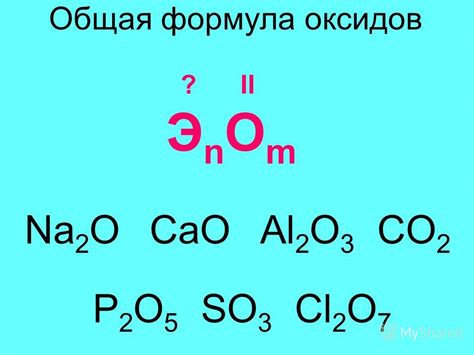
Оксиды со степенью окисления 1 имеют формулу MO, где M - металл, а O - кислород. Обычно эти оксиды образуются при сжигании металла в кислороде, например, при горении натрия в воздухе. При этом металл окисляется, а кислород восстанавливается. В результате образуется оксид металла со степенью окисления 1.
Оксиды со степенью окисления 1 обладают особыми свойствами. Например, они растворяются в воде с образованием щелочных растворов. Это связано с тем, что ионы металла в оксиде имеют положительный заряд и образуют гидроксиды, которые ионизируются в воде, образуя щелочной раствор.
Оксиды со степенью окисления 1 также могут образовываться при реакции металла с веществами, содержащими кислород. Например, натрий может образовывать оксид Na2O при взаимодействии с кислородом или оксид Na2O2 при взаимодействии с пероксидом водорода. В таких реакциях металл также окисляется до степени окисления 1, образуя соответствующий оксид.
Способы и условия образования оксидов со степенью окисления 1

Оксиды со степенью окисления 1, также известные как пероксиды, образуются в результате взаимодействия многих металлов с кислородом. Способы и условия их образования могут различаться в зависимости от свойств и химической активности металла. Оксиды со степенью окисления 1 обычно имеют видидурного или желтого цвета.
Некоторые металлы образуют пероксиды путем реакции с кислородом в присутствии влаги или воды. Например, белое железо при окислении образует пероксид железа (FeO2), который обычно называется природным белым. Также, пероксидами обладают многие щелочные металлы, такие как натрий (Na2O2) и калий (K2O2). Они образуются в результате реакции металла с кислородом в атмосфере воздуха.
Кроме того, пероксиды можно образовать путем перекисного окисления металлов гидроксидами или солями. Например, гидроксид бария (Ba(OH)2) может окисляться до образования перекиси бария (BaO2). Также, пероксид магния (MgO2) может быть получен путем окисления гидроксида магния (Mg(OH)2) в присутствии кислорода.
Образование оксидов металлами со степенями окисления 2
Оксиды металлов со степенью окисления 2 образуются при взаимодействии соответствующего металла с кислородом. Эти оксиды являются типичными неорганическими соединениями, которые имеют важное значение в химической промышленности и других областях.
Оксиды металлов со степенью окисления 2 обладают характерными свойствами. Они обычно образуют твердые вещества, которые могут быть как ионными, так и молекулярными соединениями. Ионные оксиды соединяются с водой, образуя щелочные гидроксиды, а молекулярные оксиды реагируют с водой гидролизом.
Примеры оксидов со степенью окисления 2 включают оксид железа(II) (FeO), оксид меди(II) (CuO), оксид цинка (ZnO) и оксид никеля(II) (NiO). Эти оксиды имеют различные физические и химические свойства, которые зависят от основных свойств соответствующего металла.
Оксиды металлов со степенью окисления 2 широко применяются в различных отраслях промышленности. Например, оксид железа(II) используется в производстве неорганических пигментов и магнитных материалов, а оксид цинка применяется в качестве катализатора и в производстве резин и пластмасс. Кроме того, эти оксиды используются в процессах электролиза и как сырье для получения других соединений металлов.
Таким образом, образование оксидов металлами со степенью окисления 2 является важным процессом, который имеет широкое применение в различных отраслях науки и промышленности.
Процессы и механизмы образования оксидов со степенью окисления 2

Образование оксидов со степенью окисления 2 происходит при взаимодействии металлов с кислородом. Данный процесс, называемый окислением, является универсальным для многих металлов и представляет собой реакцию, в результате которой металл переходит в оксидную форму с двумя электрическими зарядами.
Механизм образования оксидов со степенью окисления 2 зависит от свойств каждого конкретного металла. Некоторые металлы образуют оксиды при действии воздуха или кислорода в атмосфере, например, алюминий, магний, кальций и другие. Такие металлы реагируют с кислородом непосредственно, образуя оксиды со степенью окисления 2.
Другие металлы могут образовывать оксиды со степенью окисления 2 при взаимодействии с кислородом воды или кислородсодержащих растворов. Например, железо образует оксиды со степенью окисления 2 при окислении водой или раствором избыточной кислородной кислоты. Этот процесс называется гидролизом их соответствующих солей.
Образование оксидов со степенью окисления 2 является важным процессом в химической промышленности и имеет широкое применение. Оксиды металлов со степенью окисления 2 используются в качестве катализаторов, в производстве керамики, электродов для аккумуляторов и других электронных устройств.
Вопрос-ответ

Какие металлы способны образовывать оксиды со степенями окисления 1?
Металлы, способные образовывать оксиды со степенями окисления 1, включают литий (Li), калий (K), натрий (Na), рубидий (Rb) и цезий (Cs). Они образуют соответствующие оксиды, такие как Li2O, K2O, Na2O, Rb2O и Cs2O.
Как металлы образуют оксиды со степенями окисления 2?
Многие металлы могут образовывать оксиды со степенями окисления 2, такие как магний (Mg), кальций (Ca), барий (Ba), стронций (Sr), цинк (Zn) и многие другие. Например, магний образует оксид MgO, кальций образует оксид CaO, а барий образует оксид BaO.
Как связаны степень окисления металла и его оксид?
Степень окисления металла в оксиде указывает на количество электронов, переданных металлом при образовании данного оксида. Например, металл со степенью окисления 2 передал два электрона, чтобы образовать оксид со степенью окисления 2.
Какие свойства имеют оксиды металлов со степенями окисления 1 и 2?
Оксиды металлов со степенями окисления 1 обычно являются щелочными оксидами, что означает, что они образуют щелочные растворы во воде. Оксиды металлов со степенями окисления 2 могут быть как щелочными, так и амфотерными. Амфотерные оксиды могут проявлять как щелочные, так и кислотные свойства в зависимости от условий реакции.
