Щелочные металлы – это группа химических элементов, которые относятся к первой группе периодической системы. В данную группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы являются самыми реактивными металлами и характеризуются низкой плотностью и низкой температурой плавления.
Щелочные металлы обладают рядом уникальных свойств и химических особенностей. Во-первых, они обладают высокой активностью и способностью образовывать ионы с положительным зарядом. Это связано с тем, что щелочные металлы имеют всего один электрон во внешней электронной оболочке, что делает их нестабильными и склонными к реакциям.
Кроме того, щелочные металлы хорошо растворяются в воде, образуя сильные щелочные растворы. Их растворы обладают щелочными свойствами и используются в различных областях, например, в производстве мыла, стекла и удобрений.
Щелочные металлы также обладают низким значением электронной отрицательности, что делает их отличными редуцирующими агентами. Они способны легко потерять свой внешний электрон и образовать ионы с положительным зарядом, что является основой для получения множества соединений и использования их в различных отраслях промышленности.
Основные свойства щелочных металлов:

1. Высокая реактивность:
Щелочные металлы обладают высокой реактивностью и активностью, что обусловлено их низкой ионизацией и большой латентной энергией валентного электрона. Они быстро реагируют с водой, кислородом и большинством других элементов, что делает их одними из самых реактивных металлов в периодической системе.
2. Образование щелочных гидроксидов:
При реакции с водой щелочные металлы образуют гидроксиды, которые являются сильными основаниями. Это связано с образованием щелочных ионов OH- в растворе, которые придают ему щелочную реакцию.
3. Образование солей:
Многие щелочные металлы образуют соли с кислотами при реакции. Соли щелочных металлов, такие как хлорид натрия (NaCl) и нитрат калия (KNO3), часто используются в различных отраслях промышленности и в быту.
4. Низкая плотность:
Щелочные металлы имеют низкую плотность, что делает их легкими и подвижными. Например, литий - самый легкий металл в периодической системе, и калий имеет плотность, сопоставимую с плотностью воды.
5. Поздний периодический профиль:
В периодической таблице щелочные металлы расположены в первой группе. Они имеют маленькие радиусы и большое количество электронных слоев, что придает им важное значение в химии и физике.
Классификация щелочных металлов
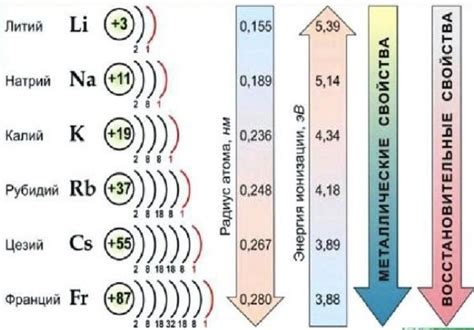
Щелочные металлы - это химические элементы, относящиеся к первой группе периодической системы. Они отличаются тем, что легко окисляются воздухом и растворяются в воде, образуя щелочные растворы. Щелочные металлы также характеризуются низкой электроотрицательностью и низкой плотностью.
Классификация щелочных металлов основывается на заряде ядра и энергии электронов в валентной оболочке. Согласно этому, щелочные металлы делятся на две группы:
Группа IА (лихиевые металлы): включает в себя элементы с однозарядными ионами, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Они имеют энергию электронов в валентной оболочке значительно ниже энергии межатомных связей, поэтому они образуют катионы с однозначным зарядом.
Группа IIА (щелочноземельные металлы): включает в себя элементы с двухзарядными ионами, такие как бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba). Эти элементы имеют более высокую энергию электронов в валентной оболочке и образуют катионы с двухзначным зарядом.
Классификация щелочных металлов важна для понимания и изучения их химических свойств и реакций. Они играют важную роль в различных отраслях науки и техники, таких как фармакология, электроника и энергетика.
Физические свойства щелочных металлов

Щелочные металлы – это группа химических элементов первой группы периодической системы, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У щелочных металлов есть некоторые характеристические физические свойства, которые делают их уникальными и полезными в различных областях науки и промышленности.
Во-первых, щелочные металлы хорошо проводят электричество. Это связано с их низкими энергиями ионизации, что позволяет электронам свободно перемещаться в кристаллической решетке металла. Именно поэтому щелочные металлы широко используются в производстве электродов и аккумуляторных батарей.
Во-вторых, щелочные металлы обладают низкими плотностями. Они являются легкими металлами, что делает их удобными для использования в легких конструкциях и летательных аппаратах. Например, литий используется в производстве легких батарей для смартфонов и ноутбуков, а алюминий-калиевый сплав применяется в авиастроении.
Также щелочные металлы обладают низкими температурами плавления и кипения. Например, калий плавится при температуре всего 63,5°C, а натрий даже при обычных условиях находится в жидком состоянии. Это делает щелочные металлы полезными для различных технологий, таких как термоэлектрические устройства и системы охлаждения.
Кроме того, щелочные металлы являются хорошими окислителями. Они легко вступают в реакции с другими веществами, особенно с кислородом. Например, литий может гореть в воздухе, образуя оксид лития (Li2O). Это свойство позволяет использовать щелочные металлы в процессах сгорания и взрывных устройствах.
Химические свойства щелочных металлов

Щелочные металлы – это элементы I группы периодической системы, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих металлов есть ряд характеристических химических свойств, которые делают их уникальными.
Во-первых, щелочные металлы очень активны с химической точки зрения. Они легко реагируют с кислородом воздуха, образуя окислы. Кроме того, они реагируют с водой, образуя щелочи и выделяя водород. В результате этих химических реакций щелочные металлы имеют ярко-металлический блеск и низкую плотность.
Во-вторых, щелочные металлы обладают высокой электроотрицательностью, что делает их очень реактивными с другими веществами. Эта реактивность проявляется в их способности образовывать ионные соединения с другими не металлами. Благодаря этим свойствам, щелочные металлы применяются в различных отраслях промышленности и науки.
В-третьих, щелочные металлы имеют низкую температуру плавления и кипения, что подтверждается данными в таблице:
| Металл | Температура плавления (°C) | Температура кипения (°C) |
|---|---|---|
| Литий (Li) | 180.5 | 1317 |
| Натрий (Na) | 97.8 | 883 |
| Калий (K) | 63.5 | 760 |
| Рубидий (Rb) | 39.3 | 686 |
| Цезий (Cs) | 28.4 | 671 |
| Франций (Fr) | 27 | 677 |
Такие низкие значения температуры показывают, что щелочные металлы могут быть легко переведены в жидкое состояние даже при относительно низких температурах.
Вопрос-ответ

Какие вещества относятся к классу щелочных металлов?
К классу щелочных металлов относятся литий, натрий, калий, рубидий, цезий и франций.
Какие основные свойства щелочных металлов можно выделить?
Основными свойствами щелочных металлов являются высокая реакционная способность, низкая плотность, низкая температура плавления, мягкость и серебристый цвет.
Какие химические реакции могут происходить с щелочными металлами?
С щелочными металлами могут происходить реакции с кислородом, водой, кислотами, аммиаком и другими химическими соединениями.
В чем особенности электронной конфигурации щелочных металлов?
Особенности электронной конфигурации щелочных металлов заключаются в том, что они имеют один валентный электрон в последней оболочке, что делает их очень реакционноспособными.
Какие применения имеют щелочные металлы?
Щелочные металлы имеют широкое применение в различных областях. Например, литий используется в производстве аккумуляторов, натрий применяется в пищевой и химической промышленности, калий является необходимым элементом для растений в сельском хозяйстве.
