Реакция металлов с кислотами является одним из важных разделов химии, который находит широкое применение как в научных исследованиях, так и в промышленности. В частности, реакция металлов с соляной кислотой является отличным примером такой химической реакции, которая происходит между металлом и кислотой, приводящая к образованию соли и выделению водорода. Эта реакция имеет свои особенности, принципиально важные для понимания ее механизма и применения в различных сферах.
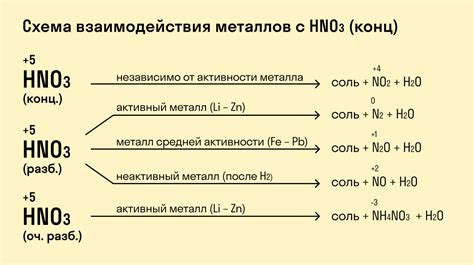
Кислота в данной реакции выступает в роли окислителя, в то время как металл — в роли восстановителя. При этом, соляная кислота (HCl) является сильным восстановителем. Соли, образующиеся в результате реакции, имеют вид хлоридов металлов, например, хлорид железа (FeCl2) или хлорид цинка (ZnCl2). Реакция соляной кислоты с металлами протекает быстро и с выделением значительного количества водорода, что делает ее очень заметной и значимой в химии.
Особенность реакции металлов с соляной кислотой заключается в выделении водорода, который может быть использован в различных сферах, начиная от промышленности и заканчивая повседневными бытовыми нуждами.
Применение реакции металлов с соляной кислотой нашло свое место в промышленности при производстве водорода, необходимого для работы водородных двигателей и производства компонентов для электрохимических процессов. Кроме того, данная реакция используется в лабораториях для получения водорода и исследования свойств различных металлов. В повседневной жизни реакция соляной кислоты с металлами может применяться для очистки и дезинфекции поверхностей, а также для получения гидрогена в бытовых условиях.
Химические свойства металлов и соляной кислоты
Металлы обладают различными химическими свойствами, включая их взаимодействие с кислотами. Одной из наиболее распространенных кислот, с которыми металлы реагируют, является соляная кислота (HCl).
Металлы и соляная кислота могут образовывать соли и выделяться водород. При взаимодействии металла с соляной кислотой молекулы кислоты распадаются, атомы водорода выделяются в виде газа.
Сила реакции металла с соляной кислотой зависит от активности металла. Например, алюминий, цинк и железо реагируют с соляной кислотой достаточно активно, при этом выделяется большое количество водорода.
Реакция металлов с соляной кислотой имеет широкое применение. В промышленности она используется для очистки поверхностей металлических изделий или удаления окислов и других загрязнений. В химической лаборатории эта реакция может использоваться для выделения водорода или получения солей металлов.
Механизм реакции металлов с соляной кислотой

Реакция металлов с соляной кислотой обладает своими особенностями, определяемыми химическими свойствами металла и соляной кислоты. Механизм этой реакции включает несколько стадий, начиная с диссоциации соляной кислоты в водном растворе. Происходит образование гидроксония и аниона хлорида, который вступает в реакцию с металлом.
На первой стадии реакции происходит адсорбция водородных ионов на поверхности металла. Это вызывает снижение степени ионизации соляной кислоты и образование нового равновесия. Далее происходит диссоциация воды на положительный ион гидроксония и отрицательный ион гидроксида.
Вторая стадия реакции – это адсорбция ионов хлорида на поверхности металла, что приводит к дальнейшей диссоциации соляной кислоты и образованию нового равновесия. В результате образуется раствор металлического хлорида и выделяется молекулярный водород.
Механизм реакции металлов с соляной кислотой может быть изменен различными факторами, такими как концентрация кислоты, температура, присутствие катализаторов и т. д. Подобные реакции имеют широкое применение в химической промышленности, в процессе получения металлических соединений или очистки металлов от загрязнений.
Выделение водорода и образование солей
Реакция металлов с соляной кислотой приводит к выделению водорода и образованию солей. Водород является одним из основных продуктов этой реакции, поскольку соляная кислота содержит ион водорода (H+). При взаимодействии металла с соляной кислотой ионы водорода из соляной кислоты замещают ионы металла. В результате этого процесса образуется соль – химическое соединение, состоящее из иона металла и ионов соляной кислоты.
Образовавшаяся соль может иметь различные свойства и физические характеристики в зависимости от типа металла, используемого в реакции, и концентрации соляной кислоты. Например, соль может быть растворимой или нерастворимой в воде. Растворимые соли образуют прозрачные или слабо мутные растворы, тогда как нерастворимые соли выпадают в осадок.
Выделение водорода и образование солей являются важной реакцией с точки зрения промышленности и научных исследований. Водород широко используется в различных отраслях, включая химическую промышленность, энергетику и производство различных продуктов. Образование солей также имеет большое значение в химии, поскольку соли используются в качестве катализаторов, питательных сред для растений, а также в многих других областях.
Применение реакции металлов с соляной кислотой в промышленности

Реакция металлов с соляной кислотой имеет широкое применение в различных отраслях промышленности. Одной из основных областей использования данной реакции является производство хлорида меди (II), который является важным сырьем при производстве различных медицинских препаратов и пигментов.
Также, данная реакция используется в процессе получения хлорида цинка, который является одним из основных компонентов гальванических элементов. Хлорид цинка также применяется при производстве специальных стекол, аккумуляторных батарей и многих других изделий в электронной промышленности.
Применение реакции металлов с соляной кислотой также распространено в процессе производства известкового раствора, который широко используется в строительной промышленности для производства штукатурки, строительных блоков и других строительных материалов.
Одним из важных применений данной реакции является получение хлора и его производных. Хлор используется в качестве основного сырья при производстве солей, пластиков, резиновых изделий, красителей и многих других химических продуктов.
Кроме того, применение реакции металлов с соляной кислотой возможно в процессе очистки и обеззараживания воды. При контакте с соляной кислотой, многие металлы окисляются и образуют соли, которые могут удалять различные загрязнения из воды и уничтожать бактерии и других микроорганизмов.
Вопрос-ответ

Какие металлы реагируют с соляной кислотой?
Соляная кислота реагирует с большинством металлов, включая, например, цинк, железо, медь и алюминий. Некоторые металлы, такие как золото и платина, не реагируют с соляной кислотой.
Какова особенность реакции соляной кислоты с металлами?
Одной из особенностей реакции металлов с соляной кислотой является выделение водорода. При взаимодействии соляной кислоты с металлом образуется соответствующая соль и молекулярный водород. Реакция протекает достаточно быстро и сопровождается выделением пузырьков газа.
Каково применение реакции металлов с соляной кислотой?
Реакция металлов с соляной кислотой находит применение в различных областях. Например, она используется для очистки и травления металлических поверхностей перед нанесением покрытий или сваркой. Также реакция может использоваться в химическом анализе для определения присутствия и содержания различных металлов.
Что происходит при реакции цинка с соляной кислотой?
При реакции цинка с соляной кислотой образуется хлорид цинка и молекулярный водород. Уравнение реакции: Zn + 2HCl -> ZnCl2 + H2. В процессе реакции выделяется газ, который можно заметить по образованию пузырьков.
Каковы возможные опасности при проведении реакции металлов с соляной кислотой?
При проведении реакции металлов с соляной кислотой необходимо соблюдать осторожность, так как соляная кислота является коррозионной и опасной для кожи и слизистых оболочек. Также при реакции может выделяться токсичный и взрывоопасный газ, поэтому реакцию следует проводить в хорошо проветриваемом помещении или под вытяжкой.
