Металлы, обладающие амфотерными свойствами, представляют собой редкое и удивительное явление в химии. Амфотерность означает способность вещества проявлять кислотные и щелочные свойства в зависимости от условий окружающей среды. То есть, такие металлы могут проявлять свои кислотные свойства в щелочной среде и щелочные свойства в кислотной среде.
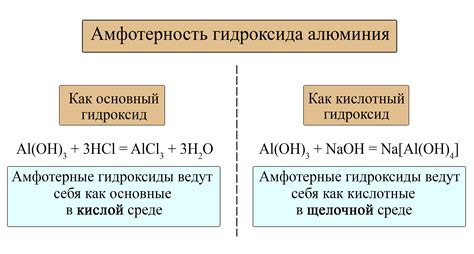
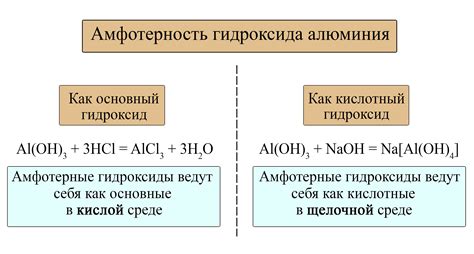
Примером металла с амфотерными свойствами является алюминий. Он проявляет кислотные свойства, реагируя с щелочами, образуя соли алюмината. Одновременно алюминий обладает щелочными свойствами в кислотной среде, формируя алюминаты. Такое поведение алюминия определяется его способностью образовывать несколько ионных форм: Al³⁺ и Al(OH)₄⁻. Такие ионы могут взаимодействовать как с кислотой, так и с щелочью.
Другим примером металла с амфотерными свойствами является цинк. Он обладает схожим поведением с алюминием. Цинк может образовывать ионы Zn²⁺ и Zn(OH)₄²⁻, которые взаимодействуют как с кислотой, так и с щелочью. В результате реакций с щелочами, цинк образует соли цинката, а с кислотами - гидроксид цинка.
Амфотерные свойства металлов: исключительное явление в химии
Амфотерные свойства металлов являются исключительным явлением в химии. Они позволяют металлам проявлять активность и реакционную способность как в кислотной, так и в щелочной среде. Эта особенность металлов делает их уникальными в химическом мире и найдет применение в различных технических и химических процессах.
Амфотерные свойства металлов обусловлены несколькими факторами. Во-первых, они связаны с наличием свободных электронов на внешней электронной оболочке, которые могут участвовать в химических реакциях. Во-вторых, амфотерность металлов связана с возможностью образования гидроксидов, которые могут проявлять как щелочные, так и кислотные свойства в зависимости от реагирующих соединений.
Примерами металлов с амфотерными свойствами являются алюминий (Al) и цинк (Zn). Алюминий обладает способностью реагировать как с кислотами, так и с щелочами. Например, он может реагировать с кислотой соляной и образовывать соединение алюминиевой соли, а также может растворяться в щелочи под образованием гидроксида алюминия.
Амфотерность металлов имеет важное прикладное значение. Например, алюминий нашел широкое применение в производстве различных конструкционных материалов, включая легкие и прочные сплавы. Также, цинк используется в гальванических элементах и в процессе гальванизации в качестве защитного покрытия для других металлов.
Что такое амфотерные свойства металлов
Амфотерные свойства металлов означают их способность проявлять кислотные и щелочные свойства в химических реакциях. Такое редкое явление порождает интерес ученых и исследователей, которые стремятся понять и объяснить механизмы данного поведения.
Металлы, обладающие амфотерными свойствами, могут реагировать как с кислотами, так и со щелочами. Взаимодействие с кислотами происходит путем отдачи одного или нескольких электронов, тогда как взаимодействие с щелочами основано на принятии электронов. Это позволяет таким металлам образовывать разнообразные соединения и демонстрировать различные реакции.
Примерами металлов с амфотерными свойствами являются алюминий, цинк, германий и некоторые другие элементы. Например, алюминий способен реагировать и с щелочами, и с кислотами. С щелочами он образует алюминаты, а с кислотами - алюминаты или алюминатные соли. Такое поведение отличает эти металлы от большинства остальных элементов, у которых нет амфотерных свойств.
Понимание механизмов амфотерного поведения металлов имеет значительное практическое значение. Эти свойства позволяют использовать такие металлы в различных областях, включая производство катализаторов, аккумуляторов, лекарственных препаратов и других продуктов химической промышленности. Исследования в этой области будут способствовать развитию новых технологий и материалов с расширенными возможностями.
Редкие случаи амфотерности в химии
Амфотерность - это свойство вещества взаимодействовать как с кислотами, так и с основаниями. В химии такие вещества считаются редкими, но их существование вызывает особый интерес у исследователей.
Одним из таких редких случаев амфотерности является класс металлов с амфотерными свойствами. Эти металлы могут проявлять как кислотные, так и основные характеристики в реакциях.
Некоторые известные примеры металлов с амфотерными свойствами включают алюминий, цинк, сурьму и кадмий. Эти металлы могут проявляться как кислоты, образуя положительные ионы, и как основания, образуя отрицательные ионы.
Важность амфотерных свойств металлов заключается в их способности принимать участие в множестве реакций, что открывает широкий спектр применений. Например, алюминий используется в производстве конструкционных материалов, а цинк - в гальванических элементах и в качестве защитного покрытия для других металлов.
Амфотерные свойства металлов являются основой для понимания механизмов химических реакций и развития новых материалов. Исследования в этой области продолжаются, и, возможно, будут открыты еще больше редких случаев амфотерности в химии, которые вызовут интерес исследователей и помогут улучшить наши знания о свойствах веществ.
Химический механизм амфотерности
Амфотерность — это способность веществ проявлять как кислотные, так и основные свойства в зависимости от условий реакции. Химический механизм амфотерности заключается в том, что амфотерные вещества содержат атомы, ионы или функциональные группы, способные как принимать, так и отдавать протоны.
Процесс проявления амфотерности включает в себя два шага: протолиз и гидролиз. Протолиз — это реакция взаимодействия амфотерного вещества с водой, при которой происходит передача протона от одного компонента к другому. Гидролиз, в свою очередь, представляет собой реакцию рассщепления воды под действием протолитического вещества.
В результате протолиза амфотерные вещества могут образовывать ионы гидроксида (OH-) и ионы оксония (H3O+), в зависимости от того, какие частицы они принимают или отдают. Кроме того, амфотерные вещества могут образовывать соли с протолитическими группами в составе. Например, амфотерный оксид алюминия (Al2O3) способен взаимодействовать и с кислотами, и с основаниями, образуя соответствующие соли.
Амфотерное поведение свойственно только некоторым веществам, и оно обусловлено особенностями их структуры и электронного строения. Это редкое явление в химии, но оно имеет важное значение для понимания реакций и свойств различных веществ.
Примеры металлов с амфотерными свойствами

В химии существуют некоторые металлы, обладающие амфотерными свойствами, то есть способностью взаимодействовать и с кислотами, и с щелочами. Одним из примеров таких металлов является алюминий (Al). Алюминий образует соли с кислотами, например, солями алюминия, которые широко используются в промышленности и в быту. Одновременно алюминий может реагировать с щелочами, например, образуя гидроксид алюминия (Al(OH)3).
Еще одним примером металла с амфотерными свойствами является цинк (Zn). Цинк взаимодействует и с кислотами, и с щелочами. С кислотами цинк образует соответствующие соли (например, сульфат цинка - ZnSO4), а с щелочами образует гидроксид цинка (Zn(OH)2).
Также можно отметить амфотерные свойства свинца (Pb). Свинец может реагировать как с кислотами, так и с щелочами. Например, соединение свинца с серной кислотой образует сульфат свинца (PbSO4), а с щелочами образует гидроксид свинца (Pb(OH)2).
Важно отметить, что металлы с амфотерными свойствами обладают широким спектром возможных реакций с различными кислотами и щелочами. Это свойство позволяет им быть универсальными веществами, используемыми в различных областях химии и промышленности.
Практическое применение амфотерных металлов

Амфотерные металлы, такие как алюминий, цинк, свинец и другие, представляют большой интерес в промышленности и научных исследованиях благодаря их способности проявлять как кислотные, так и основные свойства. Это открывает широкие возможности для их применения в различных областях.
Одно из практических применений амфотерных металлов - производство красителей и пигментов. Например, амфотерный металл алюминий используется для получения красителей, которые могут изменять цвет в зависимости от pH среды. Это делает возможным создание красок, которые могут меняться от одного оттенка до другого в зависимости от условий окружающей среды.
Амфотерные металлы также находят применение в производстве электроники и батарей. Например, цинк является ключевым компонентом в алкалиновых батареях, которые широко используются в различных устройствах, таких как пульты дистанционного управления, часы и фонари. Алюминий, благодаря своей высокой проводимости тепла и электричества, применяется в производстве электрических проводов и различных компонентов электронной техники.
Амфотерные металлы также используются в процессах очистки воды и сточных вод. Например, осадки алюминия применяются для удаления взвешенных частиц и органических загрязнений из воды. Цинк, в свою очередь, используется в системах обратного осмоса, где он способен удалять из воды различные загрязнители, такие как свинец и ртути.
Необходимо также отметить, что амфотерные металлы широко применяются в производстве косметических и фармацевтических продуктов. Их свойства позволяют создавать стабильные и безопасные формулы кремов, лосьонов и других средств, которые контактируют с кожей или используются внутрь организма. Например, амфотерный металл цинк является ключевым компонентом в мазях от солнечных ожогов и медикаментах для лечения различных кожных заболеваний.
Амфотерные свойства в живой природе: факт или миф

Амфотерные свойства - это свойства некоторых веществ, позволяющие им взаимодействовать как с кислотами, так и с основаниями. Они являются редким явлением в химии, но являются довольно важными и интересными для исследования. Многие металлы проявляют амфотерные свойства, однако встречаются ли они в живой природе - этот вопрос долгое время оставался открытым.
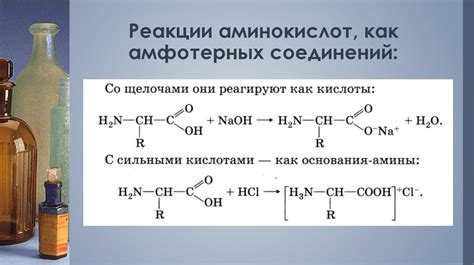
В последние годы было обнаружено, что амфотерные свойства могут проявляться в некоторых органических соединениях, включая биологически активные вещества. Например, аминокислоты, которые являются основными строительными блоками белка, способны проявлять как кислотные, так и основные свойства.
Одним из примеров амфотерности в живой природе является амфотерин, вещество, обнаруженное у некоторых видов кишечных бактерий. Это вещество является ключевым компонентом в процессе обмена азота, который играет важную роль в жизнедеятельности микроорганизмов. Амфотерин способен взаимодействовать как с кислотами, так и с основаниями, что позволяет ему регулировать уровень кислотности окружающей среды.
Благодаря амфотерным свойствам некоторых веществ, живые организмы могут адаптироваться к меняющимся условиям среды. Например, нейтрализация кислотного или щелочного вещества может быть важным механизмом защиты для многих организмов. Амфотерные свойства также могут играть роль в метаболизме и биологических процессах, таких как ферментативная активность.
Таким образом, можно сделать вывод, что амфотерные свойства в живой природе - это не миф, а реальный и довольно интересный феномен. Они позволяют организмам взаимодействовать с различными веществами и регулировать pH окружающей среды. Изучение амфотерных свойств в живой природе может привести к новым открытиям и пониманию фундаментальных процессов, происходящих в организмах.
Потенциальные перспективы исследований в области амфотерных металлов
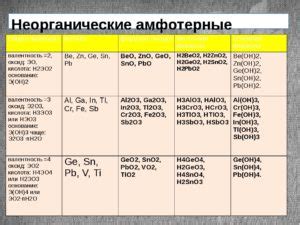
Изучение амфотерных свойств металлов представляет необычайно интересное направление в современной химии. Понимание процессов, при которых металлы могут проявлять как кислотные, так и основные свойства, открывает широкие возможности для их применения в различных областях науки и техники.
Одной из потенциальных перспектив исследований амфотерных металлов является разработка новых катализаторов. Использование таких металлов позволит улучшить эффективность различных химических процессов, а также снизить их экологическую нагрузку. Кроме того, амфотерные металлы могут быть применены в энергетике, в частности, для создания эффективных источников энергии, таких как топливные элементы.
Другая перспективная область исследований связана с использованием амфотерных металлов в медицине. Их свойство реагировать как с кислотами, так и с основаниями открывает новые возможности в разработке препаратов для лечения различных заболеваний. Более того, амфотерные металлы могут быть использованы в создании новых материалов с уникальными свойствами, например, в области нанотехнологий или создания функциональных покрытий.
Для продвижения этих исследований необходимо проводить более глубокие экспериментальные и теоретические исследования. Важно изучить механизмы, стоящие за амфотерными свойствами металлов и установить взаимосвязь между их структурой и химическим поведением. Такие исследования могут быть основой для разработки новых методов синтеза амфотерных металлов или их соединений, что позволит улучшить их свойства и расширить сферу их применения.
Вопрос-ответ

Какие металлы обладают амфотерными свойствами?
Обычно амфотерными металлами являются алюминий, галлий, индий, свинец, натрий, калий и цезий.
Что такое амфотерные свойства металлов?
Амфотерные свойства металлов указывают на их способность реагировать и с кислотами, и с основаниями. Они могут образовывать соли с кислотами и гидроксиды с основаниями.
Почему металлы с амфотерными свойствами являются редким явлением в химии?
Металлы с амфотерными свойствами являются редкими, потому что большинство металлов либо обладают только кислотными свойствами (например, железо), либо только основными свойствами (например, натрий). Амфотерные свойства возникают только у некоторых металлов, которые имеют определенную структуру и электронную конфигурацию.
