Металлы - это класс веществ, которые обладают высокой тепло- и электропроводностью, гибкостью и блеском. Эти уникальные свойства металлов обусловлены их особым строением на атомном уровне, а именно внешним энергетическим уровнем атома. Энергетический уровень внешних электронов определяет реакционную активность металлов и их способность образовывать соединения с другими элементами. Исследование внешнего энергетического уровня металлов позволяет понять и объяснить множество физических и химических свойств этих веществ.
Структура атома металла состоит из ядра и оболочек, на которых располагаются электроны. Внешний энергетический уровень металлов состоит из s и p-орбиталей, на которых находятся последние электроны в оболочке атома. Поскольку атомы металлов обладают малой электроотрицательностью и малым атомным радиусом, электроны во внешнем энергетическом уровне слабо притягиваются ядром и могут легко образовывать связи с другими атомами.
Изучение внешнего энергетического уровня металлов позволяет понять, почему они образуют ионы положительной заряды. При реакции металл отдает один или несколько своих электронов, чтобы образовать стабильный положительно заряженный ион и достигнуть октета во внешнем энергетическом уровне. Этот процесс взаимодействия металла с другими элементами является основой для образования множества соединений и соединенных с ними свойств, таких как коррозия, окисление и кислотность растворов.
Что такое химические свойства металлов?

Химические свойства металлов — это свойства, определяющие их способность взаимодействовать с другими веществами и проявлять химические реакции. Металлы обладают особым положением в периодической системе химических элементов и общими чертами в своей химии.
Одним из основных химических свойств металлов является способность образовывать положительные ионы. Это связано с их структурой и атомными связями. Металлы имеют общую электронную конфигурацию, где внешний энергетический уровень содержит от 1 до 3 электронов. Эти электроны легко отдаются, образуя положительно заряженные ионы.
Кроме того, металлы обладают высокой теплопроводностью и электропроводностью. Это связано с наличием свободных электронов, которые легко передают тепловую или электрическую энергию через кристаллическую решетку металла.
Часто металлы реагируют с кислородом и образуют оксиды. Это свойство называется окислительной активностью металлов. Отдельные металлы проявляют различную степень активности, что влияет на их реакционную способность.
Одной из характеристик металлов является их способность образовывать сплавы. Сплавы представляют собой смеси двух или более металлов, обладающие новыми свойствами. Сплавы широко используются в промышленности и имеют различные свойства, такие как повышенная прочность или улучшенная коррозионная стойкость.
По своей природе металлы обладают множеством других химических свойств, которые определяют их использование в различных отраслях науки и промышленности.
Ролевая функция внешнего энергетического уровня
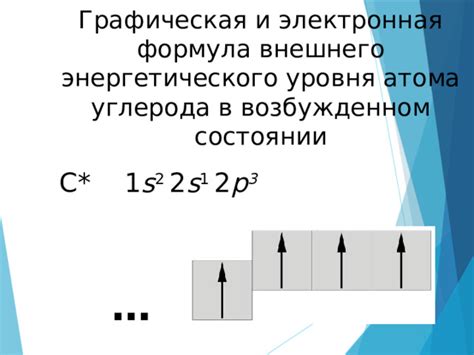
Внешний энергетический уровень играет важную роль в химических свойствах металлов. Он определяет поведение металла в реакциях, его способность образовывать соединения и проводить электрический ток. Внешний энергетический уровень обусловлен расположением электронов в атоме металла и его электронной конфигурацией.
На внешнем энергетическом уровне находится валентная оболочка металла, состоящая из электронных оболочек с самым высоким принципальным квантовым числом. Валентная оболочка представляет собой наиболее активную и реакционноспособную часть атома металла.
Количество электронов на внешнем энергетическом уровне определяет химическую активность металла. Металлы с одиночными электронами на внешнем энергетическом уровне имеют большую склонность к реакциям и образованию соединений, таким образом, они проявляются как химически активные элементы.
Однако, не все металлы обладают одиночными электронами на внешнем энергетическом уровне. Некоторые металлы имеют заполненные или частично заполненные подуровни. Такие металлы обычно проявляют меньшую химическую активность и мало реакционноспособны. Однако, они часто обладают другими полезными свойствами, такими как высокая термическая и электрическая проводимость.
Влияние химических свойств на взаимодействие с другими веществами

Химические свойства металлов определяют их взаимодействие с другими веществами. В первую очередь, это влияние обусловлено внешним энергетическим уровнем металла, на котором находятся его электроны. Высоко расположенные энергетические уровни металлов делают их хорошими донорами электронов, а взаимодействие с другими атомами и ионами является неравновесным, что приводит к образованию ионных связей.
Химические свойства металлов также определяются положением элемента в периодической системе. Металлы, находящиеся слева от периодической системы, обладают низкой электроотрицательностью и, следовательно, способны легко отдавать свои электроны. Это позволяет им образовывать положительные ионы и играть роль катионов в соединениях с другими элементами.
Взаимодействие металлов с неметаллами обусловлено их различными электроотрицательностями. Металлы, как правило, имеют низкую электроотрицательность, в то время как неметаллы характеризуются высокой электроотрицательностью. Именно поэтому металлы кислород подают, а не получают. Они имеют тенденцию образовывать ионные связи с неметаллами, в результате чего металлы образуют структуры с положительно заряженными ионами и неметаллы – отрицательно заряженными ионными связями.
Физические свойства, связанные с химическими свойствами металлов

Металлы обладают рядом физических свойств, которые непосредственно влияют на их химические свойства. Одно из основных физических свойств металлов - проводимость электричества. Благодаря высокой электропроводности, металлы широко используются в электротехнике, так как они способны передавать электрический ток без значительного ослабления.
Другое важное физическое свойство металлов - теплопроводность. Металлы хорошо проводят тепло и способны быстро и равномерно распределить его по своему объему. Благодаря этому свойству металлы широко используются в производстве теплообменных устройств, таких как радиаторы и теплообменники.
Также металлы характеризуются высокой плотностью. Их атомы плотно упакованы в кристаллической решетке, что делает металлы тяжелыми и плотными материалами. Высокая плотность металлов способствует их применению в производстве различных конструкций и механизмов, где требуется высокая прочность и надежность.
Еще одним физическим свойством металлов, связанным с их химическими свойствами, является их способность к пластичности и формоизменяемости. Металлы могут подвергаться пластической деформации без разрушения, а благодаря своей способности легко принимать различные формы и структуры, они широко используются в производстве различных изделий и деталей.
Таким образом, физические свойства металлов, такие как проводимость электричества, теплопроводность, высокая плотность, пластичность и формоизменяемость, напрямую влияют на их химические свойства и широко используются в различных сферах науки и техники.
Примеры химических реакций при взаимодействии металлов с разными веществами
Металлы активно вступают в химические реакции с различными веществами, что определяет их уникальные химические свойства. Рассмотрим несколько примеров таких реакций.
1. Реакция металлов с кислородом:
- Реакция железа и кислорода приводит к образованию ржавчины. Уравнение реакции: 4Fe + 3O2 → 2Fe2O3.
- Магний очень активно взаимодействует с кислородом, образуя оксид магния. Уравнение реакции: 2Mg + O2 → 2MgO.
2. Взаимодействие металлов с водой:
- Реакция железа с водой проходит при наличии кислорода и приводит к образованию ржавчины. Уравнение реакции: 4Fe + 3H2O + O2 → 2Fe2O3 + 3H2O.
- Натрий реагирует с водой, выделяя водород. Уравнение реакции: 2Na + 2H2O → 2NaOH + H2.
3. Взаимодействие металлов с кислотами:
- Цинк реагирует с соляной кислотой, образуя соль цинка и выделяя водород. Уравнение реакции: Zn + 2HCl → ZnCl2 + H2.
- Алюминий реагирует с серной кислотой, образуя соль алюминия и выделяя сернистый газ. Уравнение реакции: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2.
Приведенные примеры демонстрируют разнообразие химических реакций, в которых металлы выступают в качестве реагентов. Понимание данных реакций позволяет углубить наше знание о химических свойствах металлов и их участии в различных химических процессах.
Значимость изучения химических свойств металлов для различных отраслей промышленности

Металлы играют важную роль в различных отраслях промышленности, и изучение их химических свойств имеет огромное значение для обеспечения эффективной и безопасной работы производственных процессов.
В строительной отрасли химические свойства металлов позволяют создавать прочные и долговечные конструкции. Например, изучение свойств стальных сплавов позволяет разрабатывать материалы, которые обладают высокой прочностью и устойчивостью к различным воздействиям (таким как коррозия или механические нагрузки). Это особенно важно при строительстве мостов, зданий и других инфраструктурных объектов, где безопасность играет определяющую роль.
В металлургической промышленности изучение химических свойств металлов позволяет оптимизировать процессы плавки и получения сплавов. Знание свойств каждого элемента и их взаимодействия позволяет получить металлические материалы с нужными физическими и механическими характеристиками. Например, изучение свойств алюминия и его сплавов позволило развитие авиационной и космической промышленности, где важна легкость и прочность материалов.
В электротехнической отрасли химические свойства металлов играют решающую роль в создании электропроводных материалов и компонентов. Например, медь является одним из самых используемых материалов для проводов и кабелей, благодаря своим отличным электропроводным свойствам. Изучение и оптимизация химических свойств металлов позволяет разработать материалы, которые обладают нужной электропроводностью и устойчивостью к образованию окисных пленок.
Таким образом, изучение химических свойств металлов является важным направлением научных исследований, которое позволяет улучшить качество и безопасность различных производственных процессов в разных отраслях промышленности.
Вопрос-ответ

Какие свойства металлов связаны с их внешним энергетическим уровнем?
Внешний энергетический уровень металлов определяет такие их свойства, как химическая активность, способность к деформации и проводимость электричества и тепла.
Какие факторы влияют на химическую активность металлов?
Факторами, влияющими на химическую активность металлов, являются их внешний энергетический уровень и число электронов во внешней оболочке.
Почему химическая активность металлов возрастает при увеличении числа электронов во внешней оболочке?
Увеличение числа электронов во внешней оболочке металла приводит к увеличению его электроотрицательности и способности отдавать электроны. Таким образом, химическая активность металлов возрастает.
Как внешний энергетический уровень влияет на способность металлов к проводимости электричества и тепла?
Внешний энергетический уровень металлов влияет на их способность проводить электричество и тепло. Благодаря наличию свободных электронов во внешней оболочке, металлы могут эффективно передавать электронную энергию и колебательную энергию атомов.
Можно ли изменить внешний энергетический уровень металлов?
Внешний энергетический уровень металлов нельзя изменить без значительных изменений в структуре атома. Он определяется количеством электронов во внешней оболочке и характером связи между атомами в кристаллической решетке металла.
