В химических науках закон вытеснения является одним из основных принципов, описывающих реакции между металлами и солями. Этот закон позволяет нам понять, какие металлы могут вытеснить другие из их соединений и какие не могут. Изучение реакций металлов с солями является важным аспектом в области металлургии, химии и материаловедения.
Закон вытеснения основан на различии в химической активности различных металлов. Чем активнее металл, тем он более способен вытеснить другие металлы из их соединений. С помощью этого закона можно предсказать результаты реакций между различными металлами и солями. Например, цинк может вытеснить медь из ее солей, так как цинк является более активным металлом по сравнению с медью.
Одним из ярких примеров реакций металлов с солями является реакция железа с соляной кислотой. В результате этой реакции образуется хлорид железа и выделяется водород. Этот пример подчеркивает важность закона вытеснения и его применения в различных областях науки и промышленности.
Реакции металлов с солями: закон вытеснения в научной дружбе

Исследование реакций металлов с солями является одним из важных направлений в химии. Одним из ключевых законов, описывающих эти реакции, является закон вытеснения. В основе этого закона лежит принцип того, что каждый металл может вытеснить из раствора соль более дорогого металла.
При проведении экспериментов по изучению реакций металлов с солями, исследователи сталкиваются с различными результатами. Некоторые металлы проявляют большую активность и могут вытеснить из раствора большое количество других металлов. Другие металлы проявляют меньшую активность и могут быть вытеснены только определенными металлами.
Закон вытеснения является основой для исследования взаимодействия металлов в различных средах. Изучение этого закона позволяет установить порядок активности металлов и определить, какие металлы могут использоваться в качестве агентов для выделения других металлов из растворов солей.
Одним из важных применений закона вытеснения является разработка методов извлечения драгоценных металлов из руд. Этот закон позволяет определить, какие металлы можно использовать для вытеснения драгоценных металлов из их соединений. Таким образом, закон вытеснения играет важную роль в развитии процессов переработки и извлечения полезных ископаемых.
Металлы и соли: близкие друзья или вечные враги?

Металлы и соли – два основных игрока в химических реакциях, которые могут быть как сотрудниками, так и соперниками. Их взаимодействие определяет множество химических процессов, происходящих в природе и в лаборатории. Однако, между ними царит закон вытеснения – то есть, более активный металл вытесняет менее активный из своих связей с солью.
Если рассмотреть конкретные примеры, то можно заметить, что металлы и соли порой работают вместе в гармонии, а иногда ведут беспощадную химическую борьбу. Например, когда медь вступает в реакцию с серной кислотой, они взаимодействуют, образуя соль меди и сернокислоту. Здесь медь и серные ионы согласуются и создают стабильное соединение.
Однако, некоторые металлы, например, цинк или алюминий, активно реагируют с солями других металлов, вытесняя их из раствора. Это происходит из-за их большей химической активности и более высокого стандартного электродного потенциала. В результате таких реакций образуются соли активного металла и металлы менее активных металлов выпадают в осадок.
Таким образом, можно сказать, что металлы и соли - близкие друзья, которые взаимодействуют друг с другом на разных уровнях. Их взаимодействие определяет химические реакции и может как способствовать образованию стабильных соединений, так и приводить к выделению осадка. Понимая закон вытеснения, мы можем лучше понять и контролировать процессы, происходящие с этими важными химическими субстанциями.
Сильнее, больше, лучше: протагонисты в борьбе за электроны

В химических реакциях между металлами и солями возникают не только насыщенные цветом растворы, но и настоящая борьба за электроны. В этом поединке протагонистами являются металлы и соли. Каждый из них стремиться быть самым сильным и победить в схватке за электроны.
Металлы, обладая высокой электроотрицательностью и большим количеством свободных электронов, стремятся отдать свои электроны солям, для образования более стабильных соединений. Это позволяет им осуществлять окисление и вытеснение менее активных металлов из их соединений. Такой принцип действия называется законом вытеснения.
Однако не только металлы стремятся победить в этой борьбе. Соли тоже не остаются в стороне и проявляют активность в возвращении электронов обратно к металлу. У солей есть своя сила - это их степень окисления. Соли с меньшей степенью окисления сильнее конкурируют за электроны и могут настойчиво возвращать их обратно к металлу.
Все протагонисты в этом поединке играют свою роль, и каждый старается быть сильнее, больше, лучше. Анализируя результаты таких реакций, исследователи могут определить активность металлов и солей, а также выражать ее в виде ряда напряжений металлов или потенциалов окислительно-восстановительной активности веществ.
Королева реакции: соль в вытеснительных конкурсах металлов
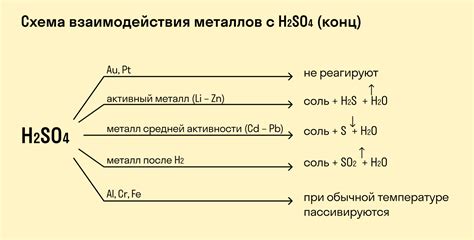
В химической борьбе между металлами и солями, соль является непревзойденным судьей. Она играет главенствующую роль в так называемых вытеснительных конкурсах, где металлы соревнуются за право реагировать с солями. В этих схватках между металлом и солью, победителем выходит тот, кто обладает выше стоящим положением в ряду силы активности металлов.
Каждый металл имеет свой уровень активности, определяющий его способность вытеснить другой металл из его соли. В соревнованиях с солью, эти металлы вступают в реакцию с солями разных металлов и показывают свою силу. Таким образом, высшая активность металла позволяет ему успешно вытеснить из соли более низкую активность металла.
И это не просто борьба за первенство в реакциях, это исследование химических свойств металлов и их способности проявить свою активность. В таблице активности металлов Уильямсона-Лизота каждый металл занимает свое место на эшелоне активности. Ниже стоящий металл не сможет вытеснить из соли выше стоящий металл, так как сила их взаимодействия будет недостаточной.
Тем не менее, некоторые металлы могут вытеснять друг друга из солей, если условия реакции сильно изменяются. Например, изменение концентрации соли или температуры может помочь металлу с низкой активностью уравнять шансы с металлом с более высокой активностью. Однако, в большинстве случаев, соль остается непоколебимым судьей и определяет исход реакции.
Вопрос-ответ

Какие реакции металлов с солями можно наблюдать?
Реакции металлов с солями могут быть разнообразными. Например, реакция железа с хлоридом меди приводит к образованию меди и хлорида железа. Реакция цинка с серной кислотой приводит к образованию сульфата цинка и выделению водорода.
Что такое закон вытеснения и как он работает в реакциях металлов с солями?
Закон вытеснения гласит, что металл может вытеснить из раствора соль металла, который находится ниже него в ряду активности. Например, цинк может вытеснить из раствора медный и железный ион, так как он находится выше их в ряду активности металлов.
Каким образом происходит реакция вытеснения металлов из солей?
Реакция вытеснения металлов из солей происходит путем электронного обмена между металлом и ионом металла в соли. Более активный металл отдает электроны менее активному металлу, приводя к образованию соответствующей соли и осаждаемому металлу.
Как можно использовать реакции металлов с солями в быту или промышленности?
Реакции металлов с солями могут быть использованы для получения металлов, очистки растворов от примесей, а также в процессах гальванического покрытия металлами. Например, реакция цинка с солями может быть использована для получения металлического цинка.
Какие факторы могут влиять на скорость реакции металлов с солями?
Скорость реакции металлов с солями может зависеть от концентрации реагентов, температуры, поверхности металла и других факторов. Чем выше концентрация и температура, тем быстрее протекает реакция. Также, использование металла в виде порошка или проволоки может увеличить скорость реакции.
