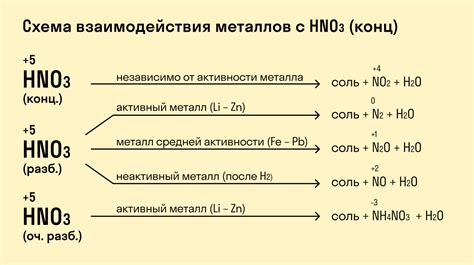
Серная кислота - это один из наиболее распространенных и хорошо известных химических соединений. Ее свойства включают высокую степень коррозионной активности и разрушительного воздействия на металлы. Великое множество металлов реагируют с концентрированной или разбавленной серной кислотой, что может иметь серьезные последствия.
При нагревании некоторые металлы могут реагировать с серной кислотой, образуя соединения, которые можно использовать в различных промышленных процессах и производствах. Однако, такие реакции часто являются нестабильными и могут иметь опасные последствия.
Наиболее известным примером металлической реакции с серной кислотой является реакция цинка с серной кислотой. При нагревании цинка с серной кислотой происходит образование сульфата цинка и выделение сернистого газа. Эта реакция может быть использована для получения цинка и его соединений.
Еще одним примером является реакция железа с серной кислотой. При нагревании железа с серной кислотой образуется сульфат железа и выделяется сернистый газ. Такие реакции часто используются для получения растворов сульфата железа, которые находят широкое применение в различных отраслях промышленности и препаративной химии.
В заключение, металлические реакции с серной кислотой при нагревании - это сложные и многогранные процессы, которые имеют как положительные, так и отрицательные стороны. Они могут быть использованы для получения ценных соединений, однако требуют особой осторожности и мер предосторожности при проведении.
Металлические реакции с серной кислотой
Серная кислота – это химическое соединение, обладающее выраженной кислотностью и широко используемое в различных отраслях промышленности. Одним из важных аспектов взаимодействия серной кислоты является ее реакция с металлами. При нагревании металлы и серная кислота взаимодействуют, образуя соль и выделяя газ.
Первоначально, реакция металлов с серной кислотой происходит за счет протекания обменных реакций. Металл отдает электроны серной кислоте, что приводит к образованию положительных и отрицательных ионов. Далее, образовавшиеся ионы образуют новые соединения, такие как соль и вода. Например, реакция цинка с серной кислотой приводит к образованию сульфата цинка (ZnSO4) и выделению газа сернистого ангидрида (SO2).
Для эффективной реакции металла и серной кислоты необходимо обеспечить определенные условия. В основном, этими условиями являются повышенная температура и наличие катализаторов. Также влияние на реакцию оказывает концентрация серной кислоты, размер и химическое состояние металла, а также продолжительность взаимодействия.
Примерами металлических реакций с серной кислотой могут служить реакции алюминия, железа, меди и других металлов. Каждая реакция имеет свои особенности, связанные с исходными веществами и промежуточными соединениями. Например, реакция алюминия с серной кислотой приводит к образованию сульфата алюминия (Al2(SO4)3), а также выделению газа сернистого ангидрида.
Особенности процесса
Реакция металлов с серной кислотой (H2SO4) при нагревании является одной из наиболее распространенных химических реакций. Она характеризуется образованием сульфатов металлов и выделением газа – диоксида серы (SO2) или сероводорода (H2S).
В зависимости от свойств металла, может образоваться два типа реакций – сильная или слабая. В случае сильной реакции, металл полностью растворяется, образуя соответствующий сульфат. В случае слабой реакции, металл не растворяется полностью, а образуется адсорбированный слой сульфата, который защищает металл от дальнейшей реакции.
Одной из особенностей процесса является выделение газа. Диоксид серы образуется при взаимодействии серной кислоты с металлами, не вступающими в реакцию с кислородом. Сероводород образуется при реакции металла с кислородом из воды. Выделение газа может сопровождаться выделением тепла и образованием пузырьков.
Примеры реакций металлов с серной кислотой при нагревании: реакция цинка (Zn) с серной кислотой (H2SO4) приводит к образованию сульфата цинка (ZnSO4) и выделению сероводорода (H2S). Реакция железа (Fe) с серной кислотой (H2SO4) приводит к образованию сульфата железа (FeSO4) и выделению диоксида серы (SO2).
Примеры реакций

Металлические реакции с серной кислотой при нагревании не только проявляются в виде образования сульфатов, но также могут сопровождаться особыми химическими реакциями с металлами.
Пример 1: Реакция железа с серной кислотой приводит к образованию сульфата железа и выделению диоксида серы и воды:
- Fe + H2SO4 → FeSO4 + SO2 + H2O
Пример 2: Реакция цинка с серной кислотой приводит к образованию сульфата цинка и выделению диоксида серы и воды:
- Zn + H2SO4 → ZnSO4 + SO2 + H2O
Пример 3: Реакция меди с серной кислотой приводит к образованию сульфата меди и выделению диоксида серы и воды:
- 2Cu + H2SO4 → CuSO4 + SO2 + H2O
Эти примеры демонстрируют, что металлические реакции с серной кислотой при нагревании происходят с образованием сульфатов металлов, при этом выделяется диоксид серы и вода. Эти реакции могут использоваться для получения сульфатов металлов или в аналитической химии для идентификации металлов.
Влияние условий нагревания

Условия нагревания являются одним из ключевых факторов, влияющих на металлические реакции с серной кислотой. Температура нагревания может значительно изменить характер реакции и скорость ее протекания.
При низких температурах нагревания, реакция между металлом и серной кислотой может протекать медленно или вообще не выполняться. Это связано с тем, что при низких температурах активность металла снижается, что затрудняет разрушение пассивной пленки оксида на поверхности металла и образование ионов металла, необходимых для реакции.
Однако при более высоких температурах нагревания происходит активное взаимодействие между металлом и серной кислотой. Высокая температура способствует разрушению пассивной пленки оксида на поверхности металла и образованию ионов металла, что ускоряет реакцию.
Также важным фактором является длительность нагревания. При более продолжительном нагревании реакция может протекать полностью, а при кратковременном нагревании - только частично. Это связано с тем, что для полного протекания реакции требуется определенное время для разрушения пассивной пленки оксида и образования достаточного количества ионов металла.
Использование реакций в промышленности

Реакции, происходящие между металлами и серной кислотой при нагревании, используются в различных отраслях промышленности. Одним из основных применений таких реакций является получение серной кислоты, которая является одним из самых важных химических соединений в промышленности. Серная кислота используется в производстве удобрений, бумаги, текстиля, пищевых добавок и др.
Также реакции с серной кислотой при нагревании используются в процессе очистки металла от окислов, жиров и других загрязнений. Например, при производстве стали серная кислота применяется для удаления окислов, образующихся на поверхности металла в процессе нагревания. Это позволяет получить чистую поверхность металла, которая не содержит загрязнений и обладает высокой прочностью.
Кроме того, реакции с серной кислотой используются в производстве батарей, аккумуляторов и гальванических элементов. Эти устройства работают на основе электрохимических реакций, и серная кислота является одним из основных электролитов в них. Она обладает высокой электропроводностью и обеспечивает стабильное функционирование электрохимических систем.
Также стоит отметить, что реакции между металлами и серной кислотой при нагревании могут быть использованы для получения водорода, который находит широкое применение в водородной энергетике, водородных топливных элементах, космической промышленности и других областях. Водород имеет высокую энергетическую плотность и является экологически чистым источником энергии.
Безопасность проведения реакций
Проведение реакций металлов с серной кислотой требует особой осторожности и соблюдения правил безопасности. Серная кислота является сильным окислителем и ядовитым веществом, поэтому необходимо работать с ней в хорошо проветриваемом помещении или под вытяжкой.
При обращении с серной кислотой необходимо использовать защитное оборудование, включая защитные очки, химические перчатки и фартук. Рекомендуется также надевать респиратор или маску, чтобы избежать вдыхания испарений кислоты.
Во время проведения реакций с серной кислотой необходимо соблюдать соблюдать меры предосторожности при работе с огнем, так как реакция может сопровождаться выделением горючих газов или паров. Также следует избегать нагревания сильнейших кислот до высоких температур, чтобы предотвратить возможность их разлома или испарения.
При контакте с серной кислотой или реакционной смесью следует немедленно промыть осколки или область контакта большим количеством воды и обратиться к медицинскому работнику для получения квалифицированной помощи.
Вопрос-ответ

Что происходит при нагревании металла с серной кислотой?
При нагревании металла с серной кислотой происходит реакция, в результате которой образуется соль и выделяется водородный газ.
Какие металлы реагируют с серной кислотой?
С серной кислотой реагируют многие активные металлы, включая такие элементы как цинк, железо, алюминий, медь и т.д.
Какой тип реакции происходит при взаимодействии металла с серной кислотой?
Реакция металла с серной кислотой является реакцией обмена или двойного разложения.
Какие условия необходимы для проведения реакции металла с серной кислотой?
Для проведения реакции металла с серной кислотой необходимо обеспечить нагревание смеси металла и кислоты и наличие стеклянной или пластиковой посуды.
Какие примеры могут быть приведены в качестве иллюстрации реакций металлов с серной кислотой?
Примерами реакций металлов с серной кислотой могут быть реакция цинка с серной кислотой, при которой образуется сульфат цинка и выделяется водородный газ, или реакция железа с серной кислотой, при которой образуется сульфат железа и выделяется водородный газ.