Взаимодействие металлов с различными химическими соединениями является одной из основных тем химической науки. Разбавленная серная кислота, или сульфатная кислота, является одним из важных соединений, с которыми реагируют металлы. Реакция металлов с разбавленной серной кислотой имеет множество применений и может быть использована в различных областях науки и промышленности.
Реакция металлов с разбавленной серной кислотой осуществляется на основе принципа окислительно-восстановительных реакций. В данном случае металл играет роль восстановителя, а серная кислота - окислителя. При реакции между металлом и разбавленной серной кислотой происходит образование соответствующего солевого соединения и выделения воды и газа.
Реактивность металлов с разбавленной серной кислотой зависит от их положения в ряду электрохимического ряда. Металлы, находящиеся выше в ряду, такие как натрий, калий и магний, реагируют с серной кислотой более активно, образуя соли и выделяя воду и водород. Металлы, находящиеся ниже, такие как железо, медь и свинец, могут реагировать с серной кислотой, но менее активно, и образуют соответствующие соли без выделения газа.
Взаимодействие металлов с разбавленной серной кислотой

Разбавленная серная кислота является химическим соединением, которое широко используется в различных отраслях науки и промышленности. Взаимодействие металлов с разбавленной серной кислотой является одной из важных химических реакций.
Во время взаимодействия металлов с разбавленной серной кислотой происходит электрохимический процесс, в результате которого образуются соли и выделяется водород. Эта реакция может протекать только с активными металлами, такими как железо, цинк, алюминий и другие.
При взаимодействии активных металлов с разбавленной серной кислотой происходит растворение металла и выделение газообразного водорода. Реакция идет с выделением тепла и может протекать очень быстро. Растворение металла происходит по специальному механизму, связанному с образованием соответствующей соли и выделением электронов.
Реакцию металлов с разбавленной серной кислотой можно использовать в качестве метода определения активности металла и сравнения их степени активности. Более активные металлы будут реагировать быстрее и более интенсивно, так как они имеют большую аффинность к кислороду и способность отдавать электроны. Например, реакция цинка с разбавленной серной кислотой проходит гораздо быстрее, чем реакция железа, что указывает на более высокую активность цинка.
Механизм реакции

Реакция металлов с разбавленной серной кислотой происходит в два этапа: первичную и вторичную. Первичная реакция заключается в образовании сульфата металла и выделении молекул водорода. Вторичная реакция представляет собой окисление образовавшегося водорода и его диспропорцирование.
На первом этапе металл реагирует с серной кислотой, вытесняя из нее водород. В результате образуется сульфат металла и молекулы водорода, которые выделяются в виде пузырей. Эта реакция является обратимой.
На втором этапе же образовавшийся водород окисляется до воды и диспропорционирует.
Серная кислота играет роль окислителя, поэтому водород отдает электроны и окисляется до воды. Одновременно другие молекулы водорода принимают электроны и образуют гидриды (нижний уровень окисления). Этот процесс называется диспропорционированием водорода.
Количество образовавшегося сульфата металла зависит от его электрохимического потенциала и активности в ряду напряжения металлов. Например, активные металлы, такие как калий или натрий, реагируют со сильным разложением кислотных и неотложных водородом выделений, при этом образуя сульфаты металлов и пропадая полностью.
Таким образом, реакция металлов с разбавленной серной кислотой происходит в два этапа и окисляет образовавшийся водород до воды в процессе диспропорционтирования. Интенсивность реакции зависит от активности металла и концентрации серной кислоты.
Окислительные свойства серной кислоты

Серная кислота (H2SO4) обладает сильными окислительными свойствами, что делает ее одним из самых мощных окислителей среди неорганических кислот. Окислительные свойства серной кислоты основаны на способности кислородного атома в серной кислоте принять электроны от других веществ.
Окислительные свойства серной кислоты проявляются во взаимодействии с различными веществами, особенно с металлами. Взаимодействие серной кислоты с металлами приводит к образованию сульфатов и выделению газов. Например, серная кислота при контакте с железом образует сульфат железа и выделяет сернистый газ (SO2).
Серная кислота может окислять не только металлы, но и некоторые органические вещества. Например, серная кислота окисляет алкены (двойные связи углерода) до соответствующих эпоксидов. Это свойство серной кислоты широко используется в органической химии для синтеза различных органических соединений.
Окислительные свойства серной кислоты могут быть определены с помощью различных химических реакций и методов анализа. Например, можно применить методы титрования, при которых известный объем серной кислоты реагирует с известным количеством вещества, окисляемого серной кислотой. Также можно использовать окислительную способность серной кислоты для определения концентрации других веществ путем их окисления до более высоких степеней окисления.
Реакция щелочных металлов

Щелочные металлы - это элементы первой группы периодической таблицы, включающие литий, натрий, калий, рубидий, цезий и франций. Они являются самыми активными металлами, поэтому реакция щелочных металлов с разбавленной серной кислотой проходит с выделением водорода и образованием соответствующих солей.
Процесс реакции начинается с образования ионов металла, которые реагируют с ионами серной кислоты, образуя соль металла и солевую кислоту. Реакция протекает с выделением водорода и сопровождается характерной искрой.
Важно отметить, что щелочные металлы реагируют с серной кислотой только при разбавлении кислоты в воде. В концентрированной серной кислоте реакция не происходит, так как концентрированная серная кислота обладает окислительными свойствами и не реагирует с щелочными металлами.
Реакция щелочных металлов с разбавленной серной кислотой является одной из основных реакций, используемых для идентификации их присутствия. Результатом реакции является образование соответствующей соли металла, которая может быть использована в различных отраслях науки и промышленности.
Реакция активных металлов

Активные металлы реагируют с разбавленной серной кислотой, образуя соль металла и выделяя газ.
К группе активных металлов относятся металлы, которые легко окисляются воздухом и реагируют с водой и кислотами. Это натрий, калий, литий и другие. Их реакция с разбавленной серной кислотой отличается высокой активностью.
При контакте активных металлов с разбавленной серной кислотой происходит обменная реакция. Металл отдает электроны, образуя положительно заряженные ионы металла, которые растворяются в реакционной среде. Вместе с тем, серная кислота отдает водородные ионы (протоны) и образует соль серной кислоты.
Реакция активных металлов с разбавленной серной кислотой сопровождается выделением водорода газа. Газ образуется из протонов и электронов, которые восстанавливаются при взаимодействии металла и кислоты. Образовавшийся водород может быть легко обнаружен с помощью горящей спички – взрывчатая смесь водорода с кислородом, получающаяся при сгорании водорода, воспламеняется.
Таблица:
| Металл | Разбавленная серная кислота | Реакция |
|---|---|---|
| Натрий | H2SO4 | Na+ + H2SO4 → Na2SO4 + H2 |
| Калий | H2SO4 | K+ + H2SO4 → K2SO4 + H2 |
| Литий | H2SO4 | Li+ + H2SO4 → Li2SO4 + H2 |
Таким образом, реакция активных металлов с разбавленной серной кислотой представляет собой окислительно-восстановительную реакцию, сопровождающуюся выделением водорода газа.
Реакция пассивных металлов
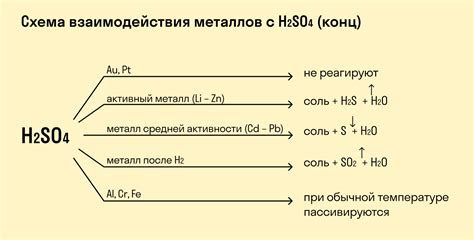
Пассивные металлы – это металлы, которые обладают способностью к образованию пленки оксида или другого соединения, которая предотвращает дальнейшее окисление металла при контакте с окружающей средой. Возможность такого образования позволяет пассивным металлам быть относительно стабильными в различных средах и при различных условиях.
К пассивным металлам относятся алюминий, нержавеющая сталь, титан и их сплавы. Реакция этих металлов с разбавленной серной кислотой происходит не так быстро, как с активными металлами, и часто сопровождается образованием пассивной пленки на поверхности металла.
Образование пассивной пленки является защитным механизмом пассивных металлов и обеспечивает им долговечность при контакте с агрессивными средами, включая разбавленную серную кислоту. Пассивная пленка предотвращает дальнейшее растворение металла и обеспечивает его стабильность и устойчивость к коррозии.
Например, нержавеющая сталь образует защитную пассивную пленку из хромового оксида, которая предотвращает продолжение реакции металла с кислотой. Такая пленка делает нержавеющую сталь устойчивой к коррозии и позволяет использовать ее в различных условиях, включая контакт с разбавленной серной кислотой.
Вопрос-ответ

Какова химическая реакция между металлами и разбавленной серной кислотой?
Химическая реакция между металлами и разбавленной серной кислотой происходит с образованием соли и выделением водорода. Общая реакция можно представить следующим образом: металл + серная кислота = соль металла + водород. Например, реакция железа с разбавленной серной кислотой выглядит так: Fe + H2SO4 = FeSO4 + H2.
Какие металлы реагируют с разбавленной серной кислотой?
С разбавленной серной кислотой реагируют многие активные металлы, такие как железо, цинк, медь, алюминий и магний. Эти металлы не только образуют соли серной кислоты, но и выделяют водород при реакции. Однако, некоторые металлы, такие как золото и платина, не реагируют с разбавленной серной кислотой.
