Реактивность металлов с растворами кислот является важным аспектом химических реакций и находит широкое применение в различных сферах, таких как промышленность и научные исследования. Эта реакция основана на обмене электронами между металлом и кислотой, что приводит к образованию соли и выделению водорода.
Металлы могут проявлять различную степень реактивности с кислотами в зависимости от их электрохимических свойств и положения в ряду активности металлов. Например, активные металлы, такие как натрий и калий, реагируют сильно и быстро с кислотами, освобождая значительное количество водорода и образуя соли.
С другой стороны, менее активные металлы, такие как железо и цинк, реагируют медленнее и менее интенсивно, образуя менее активные соли. Некоторые металлы, такие как золото и платина, практически не реагируют с кислотами и считаются химически инертными.
Важно отметить, что реактивность металла с растворами кислот может быть определена не только его положением в ряду активности металлов, но и другими факторами, такими как концентрация кислоты и температура окружающей среды.
Реакция металлов с растворами кислот может иметь практическое значение в различных областях жизни. Например, она используется при очистке металлических поверхностей от ржавчины и других загрязнений, а также в процессе получения металлов из руд. Также, эта реакция является основой для различных опытов и исследований в области химии и науки в целом.
Реактивность металлов
Реактивность металлов определяется их способностью соединяться с другими веществами в результате химических реакций. Она зависит от электрохимического потенциала металла, его степени активности, а также условий окружающей среды.
Активные металлы, такие как литий, натрий, калий и магний, обладают высокой reактивностью. Они реагируют с растворами кислот, образуя соли и выделяя водородный газ. Например, реакция между металлом натрия и серной кислотой приводит к образованию сульфата натрия и выделению водорода.
Металлы средней активности, такие как цинк и железо, тоже могут реагировать с кислотами. Однако их реакционная способность ниже, поэтому реакция может протекать медленнее и требовать более концентрированных или сильных кислотных растворов.
Малоактивные металлы, такие как свинец или золото, обычно не реагируют с обычными кислотами при комнатной температуре.
Реактивность металлов может быть использована в различных областях, таких как производство водорода, очистка отходов и производство металлов.
Свойства и особенности

1. Скорость реакции: Металлы проявляют разную скорость реакции с кислотами. Некоторые металлы, такие как натрий и калий, реагируют с кислотами очень быстро и интенсивно, выделяя большое количество водорода. Другие металлы, например, медь или свинец, могут реагировать крайне медленно или даже не реагировать вообще.
2. Реакционная способность: Металлы могут проявлять разную реакционную способность с кислотами. Некоторые металлы, такие как алюминий или цинк, проявляют амфотерные свойства и реагируют как с кислотами, так и с щелочами. Это связано с их способностью образовывать соли как с кислотами, так и с основаниями.
3. Выделение водорода: В реакции с кислотами многие металлы выделяют водород. Выделение водорода может происходить как спонтанно, так и с высвобождением большого количества газа. Это связано с химическими свойствами металлов и их реакцией с протонами водородного иона.
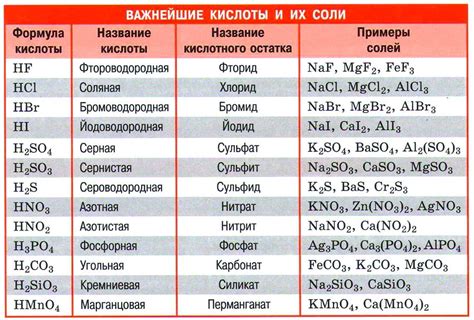
4. Образование солей: Реакция металлов с кислотами приводит к образованию солей. Соли образуются на основе анионов, которые остаются после того, как протоны были отданы кислотой металлу. Образование солей является результатом ионообменной реакции и является основным продуктом реакции металла с кислотой.
5. Коррозия металлов: Некоторые металлы могут подвергаться коррозии при взаимодействии с кислотами. Например, железо при длительном воздействии сильных кислот может образовывать железные соли, которые могут вызвать разрушение металла. Это связано с электрохимическими свойствами металла и его способностью реагировать с протонами кислоты.
Взаимодействие с кислотами

Металлы способны активно взаимодействовать с кислотами и превращаться в соответствующие соли. В зависимости от свойств металла и кислоты, эти реакции могут происходить различными способами и сопровождаться выделением газов, тепла или сменой окраски раствора.
Некоторые металлы, например, щелочные металлы и щелочноземельные металлы, реагируют с кислотами активно и интенсивно, образуя соли и выделяя водородный газ. Такая реакция происходит очень быстро и сопровождается выделением тепла. Например, при взаимодействии металла натрия с соляной кислотой формируется хлорид натрия и образуется большое количество пузырьков водорода.
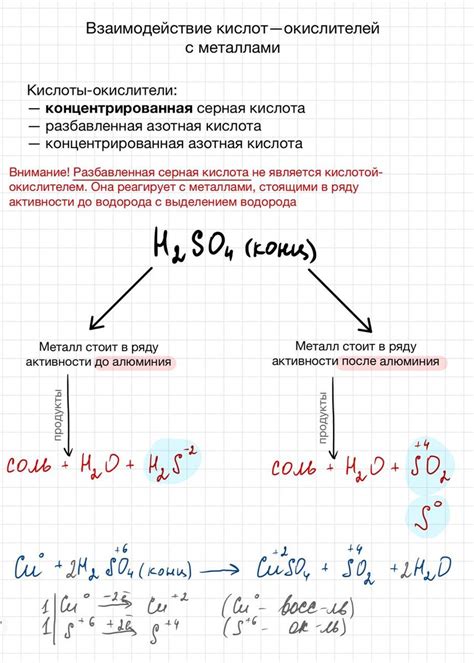
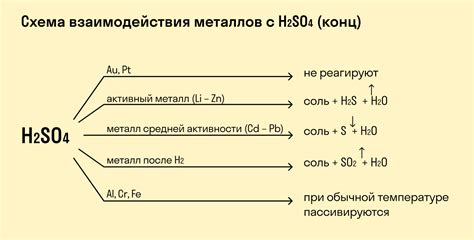
Другие металлы, такие как железо, цинк и алюминий, также обладают реакционной способностью по отношению к кислотам. Но в отличие от щелочных металлов, они реагируют с кислотами медленнее. Реакция этих металлов с кислотами может сопровождаться как выделением газа (например, образованием водорода), так и изменением окраски раствора (образование соответствующих солей металлов).
Однако не все металлы реагируют с кислотами. Аллюминий и хром, например, образуют защитные пленки оксида и не взаимодействуют с кислотами в обычных условиях. Также некоторые редкоземельные металлы малоактивны и проявляют реакционную способность только в сильных кислотах или при повышении температуры.
Основные факты и свойства

Реактивность металлов с растворами кислот характеризуется их способностью образовывать соли и выделяться водород в процессе химической реакции. Каждый металл обладает своей степенью реактивности, что определяется его положением в ряду активности металлов.
Активные металлы, такие как магний, натрий и калий, реагируют с растворами кислот очень быстро и интенсивно. Эти металлы способны растворяться в кислоте с образованием соли и выделением водорода. Реакция активных металлов с кислотами является экзотермической и сопровождается выделением тепла.
Некоторые металлы, такие как алюминий и цинк, проявляют слабую реактивность. Они реагируют с растворами кислот, но скорость реакции значительно меньше, по сравнению с активными металлами. При этом они также образуют соли и выделяют водород.
Пассивные металлы, например, медь и серебро, не реагируют с кислотами при комнатной температуре. Они могут образовывать соли только при нагревании или при использовании концентрированных растворов кислот.
Реакция металлов с растворами кислот является одним из основных методов получения солей. Реактивность металлов с кислотами позволяет использовать их в различных технологических и химических процессах, например, при производстве удобрений, синтезе органических соединений и промышленной очистке металлообразующих жидкостей.
Коррозия и окисление

Коррозия металлов — это процесс разрушения материала под воздействием окружающей среды. Одной из наиболее распространенных причин коррозии является окисление металлов, которое чаще всего происходит при взаимодействии с кислотными растворами. В результате окисления металла его поверхность покрывается оксидной пленкой, которая затем может продолжать растворяться под действием кислоты.
Окисление металлов является химическим процессом, при котором происходит передача электронов от металла к кислоте. Это может привести к образованию новых соединений, таких как металлические соли и водород. Некоторые металлы, такие как алюминий и цинк, имеют высокую реактивность и легко окисляются при взаимодействии с кислотами.
В результате коррозии и окисления металлов часто происходит разрушение конструкций и изделий из металла. Для предотвращения коррозии и увеличения срока службы металлических изделий применяют различные методы защиты, например покрытия поверхности специальными защитными пленками или использование антикоррозионных добавок при производстве металлических материалов.
Однако не все металлы подвержены коррозии и окислению в одинаковой степени. Некоторые металлы, такие как золото и платина, обладают высокой устойчивостью к окислению и практически не коррозируют при взаимодействии с кислотами. Другие металлы, такие как железо и медь, более подвержены коррозии и требуют особой защиты для предотвращения разрушения.
Вопрос-ответ

Какие металлы реагируют с кислотами?
Ряд металлов реагирует с кислотами, но наиболее активные из них - это металлы щелочных металлов (например, натрия, калия) и щелочноземельных металлов (например, магния, кальция).
Каков механизм реакции металлов с кислотами?
Металл реагирует с кислотой путем отдачи электронов и образования ионов металла и ионов водорода. Это реакция окислительного взаимодействия.
Какие вещества образуются в результате реакции металла с кислотой?
При реакции металла с кислотой образуются соли и освобождается водород. Например, при реакции натрия с соляной кислотой образуется хлорид натрия и выделяется водород.
Как зависит скорость реакции металла с кислотой от их активности?
Скорость реакции металла с кислотой зависит от активности металла. Чем более активный металл, тем быстрее происходит реакция. Например, натрий реагирует с кислотой гораздо быстрее, чем медь.