Металлы - это особый класс элементов, которые обладают высокой электропроводностью, термической и химической устойчивостью. Одной из важных характеристик металлов является их способность образовывать соединения с различными элементами, включая кислород. Когда металл вступает в реакцию с кислородом, образуется оксид металла, в котором металл находится в своей высшей степени окисления.
Высшая степень окисления металла имеет важное значение для понимания его свойств и реакционной способности. Она определяет, сколько электронов металл может потерять при взаимодействии с другими веществами. Чем выше степень окисления, тем больше электронов может потерять металл и тем сильнее реактивен может быть оксид металла.
Например, железо может образовывать соединения с разными степенями окисления, включая FeO, Fe2O3 и Fe3O4. В оксиде FeO железо находится в более низкой степени окисления, потому что оно потеряло только один электрон. В то же время, в оксиде Fe3O4 железо находится в высшей степени окисления, потому что оно потеряло три электрона. Это делает Fe3O4 более реактивным по сравнению с FeO.
Высшая степень окисления металла также может влиять на его физические свойства, такие как цвет и магнитные свойства. Например, в высших степенях окисления некоторых металлов, таких как медь и хром, образуется окрашенный оксид, что позволяет использовать их в качестве пигментов для красок и керамики. Кроме того, некоторые оксиды металлов могут обладать магнитными свойствами, что открывает новые возможности для применения в магнитных материалах и устройствах.
Металлы и реакция окисления
Металлы, как класс химических элементов, обладают способностью реагировать с оксидами и другими веществами, проявляя реакцию окисления. Окисление - это процесс, при котором металл переходит из нейтрального состояния в положительное окисное состояние.
Процесс окисления металлов сопровождается образованием оксидов, которые могут иметь разные степени окисления. Высшая степень окисления - это наибольшее положительное зарядное состояние металла.
Металлы, имеющие высшую степень окисления, обычно образуют стабильные оксиды, которые служат защитной пленкой, предотвращающей дальнейшее окисление металла.
Однако, некоторые металлы, такие как железо, медь или цинк, имеют несколько степеней окисления и могут образовывать различные оксиды в зависимости от условий окружающей среды и их реактивности.
Реакция окисления металлов имеет большое значение в различных процессах, таких как коррозия или производство электроэнергии. Понимание особенностей проявления реакции окисления металлов позволяет разрабатывать методы и способы предотвращения коррозии и оптимизации процессов электролиза и гальванизации.
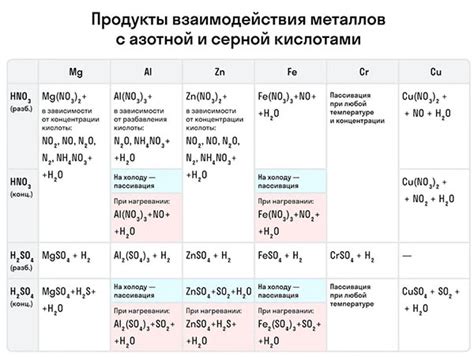
В таблице представлены некоторые примеры металлов с их высшими степенями окисления:
- Железо: Fe(III), Fe(II)
- Медь: Cu(II), Cu(I)
- Цинк: Zn(II)
- Алюминий: Al(III)
- Свинец: Pb(IV)
Металлы в химических реакциях

Металлы обладают способностью активно участвовать в химических реакциях благодаря своей электроактивности. Одной из основных характеристик металлов является их способность образовывать положительные ионы - катионы. В процессе химических реакций, металлы готовы отдавать электроны внешним атомам и соединениям с низшей степенью окисления.
Самая типичная химическая реакция, в которой участвуют металлы, - это окислительно-восстановительные реакции. В реакциях окисления металлы отдают электроны, при этом сами окисляются - образуются ионы с высшей степенью окисления. В то же время, восстановительные агенты получают электроны и переходят в состояние с низшей степенью окисления.
Металлы также способны реагировать с кислородом, образуя оксиды. В этом случае металл осуществляет окисление, а кислород выступает как окислитель. Это одна из главных причин, почему металлы часто подвергаются окислительной коррозии.
Другим важным типом реакций, в которых участвуют металлы, являются реакции с кислотами. Кислоты, обладая высокой концентрацией водородных ионов, способны образовывать соли с металлами. В результате таких реакций образуется вода и соль металла, состоящая из катиона металла и аниона кислоты.
Окисление: суть процесса
Окисление - это процесс, который происходит при взаимодействии вещества с кислородом или другими окислителями. В результате окисления, атомы вещества теряют электроны, образуя положительно заряженные ионы, называемые катионами.
Окисление может протекать в разных условиях и иметь разное температурное и энергетическое значение. Оно может быть как быстрым и интенсивным процессом, так и медленным и практически незаметным.
В химии окисление обычно сопровождается реакцией, при которой одно вещество окисляется, а другое вещество выступает в качестве окислителя. Это связано с переносом электронов от окисляемого вещества к окислителю.
Окисление имеет особое значение в химии металлов. Некоторые металлы способны образовывать несколько степеней окисления, в которых они образуют соединения с разным количеством окислителей. Это связано с тем, что металлы имеют достаточно слабую связь с электронами, что делает их подверженными окислению.
Высшая степень окисления
Высшая степень окисления - это наивысшая степень окисления, которую может достичь атом металла при образовании соединения. Окисление - это процесс передачи электронов от металла к неметаллу или отрицательно заряженному иону. Высшая степень окисления может быть положительной, отрицательной или нулевой в зависимости от того, какие ионы образовываются в реакции.
Высшая степень окисления металла может быть определена по электроотрицательности атома металла и реакциям, которые он может образовать. Чем выше электроотрицательность металла, тем выше его высшая степень окисления. Например, водород имеет высшую степень окисления +1, а кислород -2.
В соединениях с несколькими металлами, каждый из них может иметь свою высшую степень окисления, которая определяется его электроотрицательностью и взаимодействием с другими элементами. Например, в соединении Fe₃O₄ (магнетит) железо имеет степень окисления +2 и +3, а кислород -2.
Высшая степень окисления металла может иметь важное значение в химических реакциях и использоваться для определения состава соединений. Она также может влиять на свойства соединений и их способность взаимодействовать с другими веществами. Познание высших степеней окисления металлов является важным аспектом изучения химии и позволяет получить глубокое понимание реакционной способности и химического поведения металлов.
Проявления высшей степени окисления

Высшая степень окисления – это значение максимальной положительной зарядности, которую может принять атом металла при образовании соединений. Как правило, высшая степень окисления соответствует предельному числу электронов, которые могут быть переданы металлом в реакции соединения с другими элементами.
Проявления высшей степени окисления встречаются у многих металлов. Например, у марганца высшая степень окисления +7, что означает, что он может передать в реакции до семи электронов. У хрома высшая степень окисления +6, а у свинца она равна +4. Также высшую степень окисления имеют металлы, входящие в состав пероксидов, халатов и других соединений.
Проявления высшей степени окисления часто связаны с высокой активностью металла и его способностью образовывать стабильные соединения с другими элементами. Например, присутствие высшей степени окисления может указывать на возможность образования сильных оксидов или кислот, которые широко используются в различных процессах и технологиях.
Изучение проявления высшей степени окисления важно для понимания свойств и реакционной способности металлов, а также для разработки новых материалов, соединений и производственных процессов. Ученые постоянно расширяют границы знаний о высшей степени окисления различных металлов, что способствует развитию науки и технологий в различных областях промышленности и научного исследования.
Вопрос-ответ

Какие металлы имеют наибольшую высшую степень окисления?
Наибольшую высшую степень окисления имеют металлы из группы платиновых (платина, иридий, осмий), а также рутений и хром.
Какая роль высшей степени окисления у металлов в природе?
Высшая степень окисления у металлов играет важную роль в различных химических процессах, таких как реакции окисления, катализ, а также в формировании оксидов, которые используются в производстве красителей, катализаторов и других веществ.
Как можно определить высшую степень окисления у металла в соединении?
Высшую степень окисления у металла в соединении можно определить по заряду, который металл принимает при образовании ионов в данном соединении. Например, если металл имеет положительный заряд +3, то его высшая степень окисления будет равна 3.
Как высшая степень окисления металлов связана с их реакционной способностью?
Высшая степень окисления металлов обычно связана с их высокой реакционной способностью. Металлы с более высокими степенями окисления чаще участвуют в реакциях окисления-восстановления и имеют большую энергию окисления.
Как металлы могут проявить разные степени окисления в разных соединениях?
Металлы могут проявить разные степени окисления в разных соединениях из-за различных окислительных или восстановительных свойств других веществ, с которыми они реагируют. Также металлы могут иметь разные степени окисления в зависимости от условий реакции, таких как температура и давление.
