Электролиз – это химический процесс, осуществляемый с помощью электрического тока, который применяется для получения различных металлов из водных растворов. Этот метод широко используется в промышленности для производства металлов, таких как алюминий, медь, свинец и многие другие.
Процесс электролиза основан на использовании электролита – вещества, которое разлагается под действием электрического тока на положительно и отрицательно заряженные ионы. Положительные ионы, называемые катионами, притягиваются к отрицательному электроду, а отрицательные ионы, называемые анионами, притягиваются к положительному электроду.
Процесс электролиза состоит из нескольких стадий. На первой стадии происходит прохождение электрического тока через электролит, что приводит к электролизу вещества и образованию ионов. На следующей стадии происходит движение ионов к соответствующим электродам – положительным и отрицательным, где они реагируют и осаждаются в виде металла на поверхности электродов.
Процесс электролиза является важным методом получения металлов с высокой степенью чистоты, так как он позволяет удалять примеси и другие загрязнения из раствора. Кроме того, электролиз позволяет получать металлы с определенной формой и структурой, что не всегда возможно с помощью других методов производства.
Электролиз является одним из основных способов получения металлов из водных растворов и играет важную роль в промышленности и научных исследованиях. Он применяется не только для получения металлов, но и для получения различных соединений и растворов, а также в электрохимических процессах, таких как гальваническое покрытие и аккумуляторные системы.
Электролиз: получение металлов

Электролиз – это процесс, при котором металлы получают из водных растворов с помощью электрического тока. Для проведения электролиза необходимы специальные установки – электролизеры. Они состоят из электродов, которые погружаются в раствор и служат источником электрического тока.
В процессе электролиза положительно заряженный электрод – анод – приводит к окислению анионы в растворе, а отрицательно заряженный электрод – катод – приводит к редукции катиона в растворе. Таким образом, металлы осаждается на катоде в виде металлического покрытия или сохраняет свою структуру.
Электролиз является эффективным способом получения различных металлов, таких как золото, серебро, никель, медь и другие. Кроме того, электролиз позволяет улучшить качество металла и устранить примеси, так как проводится в контролируемых условиях.
Процесс электролиза используется в различных отраслях промышленности, включая металлургию, химию, электронику и др. Он также широко применяется в лабораторных условиях для исследования свойств и качества различных металлов.
Принципы электролиза металлов из водных растворов
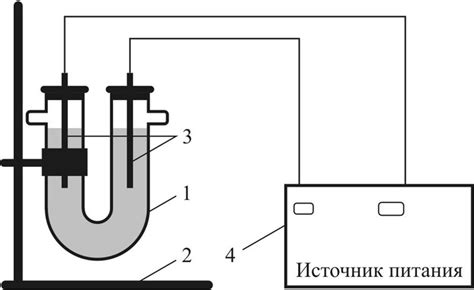
Электролиз – это процесс разложения соединений с использованием электрического тока. Он играет важную роль в получении металлов из водных растворов. Принцип электролиза заключается в применении постоянного электрического тока к электролиту, состоящему из раствора вещества, которое намерены получить.
Одним из ключевых элементов электролиза является электрод, привязанный к положительному (+) и отрицательному (-) полюсам электрической цепи. Электроды, окунутые в раствор, называют анодом (отрицательный полюс) и катодом (положительный полюс). На аноде происходит окисление, а на катоде - восстановление и осаждение металла.
Для эффективного электролиза металлов из водных растворов необходимо выбрать подходящий электролит, который содержит растворенные соли металла. При подаче электрического тока на электролит происходит разложение соли на ионы металла, которые перемещаются к катоду и осаждаются на его поверхности в виде металлического осадка.
Важно учитывать, что для получения металла с помощью электролиза, необходимо обеспечить достаточно высокую электродвижущую силу (ЭДС) и контролировать скорость осаждения. Параметры, такие как ток, время и температура, играют решающую роль в эффективности и качестве процесса электролиза.
Преимущества электролиза по сравнению с другими способами

Электролиз является эффективным способом получения металлов, особенно из водных растворов. Вот несколько преимуществ данного метода:
- Экономическая эффективность: Процесс электролиза является дешевым и эффективным, так как требует относительно небольших затрат энергии для получения металлов.
- Выбор металлов: Электролиз позволяет получать широкий спектр металлов, включая ценные редкоземельные элементы и платину, которые трудно извлекать другими способами.
- Высокая чистота продукции: Электролиз позволяет получать металлы высокой чистоты, так как процесс основан на селективной реакции на электрические потенциалы металлов.
- Удобство управления: Процесс электролиза легко контролируется, позволяя регулировать химические и физические свойства конечного продукта.
- Меньшая экологическая нагрузка: В отличие от некоторых других методов производства металлов, электролиз обычно имеет меньшую экологическую нагрузку и меньший отрицательный воздействие на окружающую среду.
Итак, электролиз является эффективным и удобным способом получения металлов из водных растворов, предъявляющим ряд преимуществ по сравнению с другими методами.
Применение электролиза в различных отраслях промышленности

Электролиз – это процесс разложения вещества под воздействием электрического тока. Этот метод нашел широкое применение в различных отраслях промышленности и является важным способом получения металлов из водных растворов.
Одной из отраслей, где применяется электролиз, является производство хлора и щелочей. В процессе электролиза нейтральная соль разлагается на катоде, при этом образуется щелочь, а на аноде – хлор газ. Подобным образом, через электролиз получают калий, натрий и другие щелочные металлы.
Электролиз также активно применяется в гальванической промышленности. В процессе гальванического покрытия на поверхности изделия формируется покрытие из различных металлов – золото, серебро, медь и др. Электролиз позволяет создавать декоративные и защитные покрытия, а также повышать износостойкость и электропроводность деталей.
Еще одна отрасль, где используется электролиз, – это производство алюминия. Этот металл получают из руды, проводя электролиз в расплаве. В процессе разложения руды на катоде осаждаются алюминий и другие металлы, а на аноде выделяется кислород. Применение электролиза позволяет получать алюминий с высокой степенью очистки и высокой электропроводностью.
В металлургии также используется электролиз. Этот метод применяется для очистки и извлечения металлов из руды, а также для получения сплавов. С помощью электролиза можно получить металлы такие, как медь, цинк, свинец, никель и др. Это позволяет увеличить эффективность и экономичность процессов металлургического производства.
Влияние электролиза на окружающую среду

Процесс электролиза, используемый для получения металлов из водных растворов, может оказывать значительное влияние на окружающую среду. Во-первых, при этом процессе может использоваться большое количество электроэнергии, что ведет к выбросу дополнительных парниковых газов в атмосферу. Это может негативно сказываться на климатических изменениях и приводить к увеличению парникового эффекта.
Во-вторых, электролиз водных растворов может приводить к образованию различных химических соединений, которые могут быть токсичными для окружающей среды. Например, при электролизе воды в результате реакции на электродах может образовываться хлор. Хлор является высоко токсичным веществом и может оказывать вредное воздействие на окружающую среду и здоровье человека.
Кроме того, при электролизе растворов могут образовываться отходы, содержащие различные химические вещества. Эти отходы часто нуждаются в специальной обработке и удалении, чтобы предотвратить негативное воздействие на окружающую среду. Несоблюдение правил обращения с отходами от электролиза может привести к загрязнению почвы и водных ресурсов, а также вызвать нарушение экосистем в окружающих районах.
Таким образом, электролиз, несмотря на свою значимость в процессе получения металлов, имеет негативное влияние на окружающую среду. Для минимизации этого влияния необходимо применять энергоэффективные технологии, строго контролировать выбросы газов и обращаться с отходами в соответствии с экологическими требованиями.
Вопрос-ответ

Как работает электролиз?
Электролиз - это процесс разложения вещества под действием электрического тока. В случае получения металлов из водных растворов, электролиз проводится в электролитической ячейке, в которой находятся два электрода – катод и анод. При подаче постоянного тока на ячейку, катод притягивает положительно заряженные ионы металла, которые восстанавливаются на нем и формируют металлическое осаждение. Анод в то же время освобождает отрицательно заряженные ионы, которые соединяются с водой и образуют окислительные вещества.
Какие металлы можно получить с помощью электролиза из водных растворов?
Из водных растворов с помощью электролиза можно получить различные металлы. Некоторые из них встречаются в природе в виде солей, например, медь, цинк, свинец. Для получения этих металлов из растворов используется соответствующая соль. Кроме того, с помощью электролиза можно получить драгоценные металлы, такие как золото и серебро. Они практически не встречаются в природе в виде ионов, но из их соединений также можно получить металлы с помощью электролиза.
Что происходит с водой при электролизе?
При электролизе воды происходит разложение ее молекул на элементы: кислород и водород. На катоде образуется водород, который выводится в виде пузырьков. На аноде происходит окисление ионов воды, с образованием кислорода. Итоговое уравнение электролиза воды выглядит следующим образом: 2H2O(l) → 2H2(g) + O2(g).
