Электролиз – это процесс, при котором электрический ток приводит к разложению вещества на его компоненты под воздействием электролита. В случае с металлами, получаемыми электролизом водных растворов их солей, происходит разложение соли при проведении тока через раствор.
При электролизе водных растворов металлов происходит окисление исходного металла на аноде, а снижение его окислительной способности между анодом и катодом приводит к осаждению металла на катоде. Таким образом, электролиз является эффективным методом для получения различных металлов.
Металлы, получаемые электролизом водных растворов их солей, находят широкое применение в различных отраслях промышленности. Они используются для производства различных изделий, от электродов и проводов до автомобилей и строительных конструкций. Кроме того, электролиз является важным этапом в получении ряда металлов, таких как алюминий, цинк и медь, которые имеют огромное значение в современной экономике и технологии.
Обладая высокой степенью чистоты и свойствами, полученными в результате электролиза, эти металлы находят применение в различных отраслях промышленности и научных исследованиях. Продолжение исследований в области электролиза и получения металлов позволяет улучшить процессы их производства, а также находить новые способы получения ценных металлов для современных технологий и инноваций.
Водород

Водород – самый легкий и распространенный химический элемент во Вселенной. Он присутствует во многих природных соединениях, а также в воде и водных растворах различных солей. Водород обладает своеобразными химическими свойствами и широко используется в промышленности.
Водород можно получить путем электролиза воды или растворов его солей. При этом на катоде образуется молекулярный водород, а на аноде – кислород. Этот процесс основан на разложении воды на водород и кислород под воздействием электрического тока.
Полученный водород используется в различных отраслях промышленности. Например, водород является важным сырьем для производства аммиака, который используется в производстве удобрений. Водород также применяется в процессе восстановления металлов из их окислов, таких как железо, никель и другие.
Кроме того, водород используется в производстве водородных топливных элементов и водородных батарей. Водородные топливные элементы являются энергоэффективным и экологически чистым источником энергии. Они могут использоваться в автомобилях, станциях бесперебойного питания и других устройствах.
Таким образом, водород – важный элемент химической промышленности, который можно получить путем электролиза воды или растворов его солей. Он широко используется в различных отраслях промышленности и современных технологиях, играя важную роль в процессах восстановления металлов и производстве энергии.
Электролиз водных растворов солей

Электролиз – это процесс разложения вещества на ионы при прохождении электрического тока через него. В случае электролиза водных растворов солей, вода действует в качестве электролита, а соль, растворенная в ней, распадается на положительные и отрицательные ионы.
При проведении электролиза водного раствора соли на аноде образуются кислород и положительный ион соли, а на катоде образуются водород и отрицательный ион соли. Процесс электролиза позволяет получать металлы, если ионы металла обладают полученной при электролизе энергией и не взаимодействуют с водородом и кислородом.
Например: при электролизе водного раствора серной кислоты с солями металлов, на катоде будет осаждаться соответствующий металл, а на аноде будет образовываться кислород.
Электролиз водных растворов солей находит применение в промышленности при получении ряда металлов, таких как натрий, алюминий, магний, цинк и другие. Этот метод является сравнительно недорогим и эффективным способом получения металлов.
Кислород

Кислород - химический элемент, символ O, атомный номер 8. Он является важным компонентом воды, а также основным компонентом атмосферы Земли. Кислород широко используется в промышленности для сжигания, окисления и дыхания.
Кислород также является важным элементом в химических процессах и реакциях. Он может соединяться с другими элементами для образования оксидов. Кислородные соединения широко применяются в различных отраслях промышленности, включая производство стали, азотной кислоты и пластмасс.
Электролиз водного раствора соли оксидов кислорода, таких как перманганат калия, позволяет получить кислород. В ходе электролиза происходит разложение воды, при котором кислород выделяется на аноде в виде газа.
Кислородный катод:
- После нагревания главные металлы изготавливаются из оксидов. Материалом для катода типирующей окутки является чистый кислород, воздушная симметричная субстанция, инертная на кислороде и солнечной энергии.
- Кислород в катоде создает тепло, необходимое для расплавления перманганата калия. В этом процессе газ образуется только на катоде.
Кислород:
- Образование кислорода происходит на аноде, на который подается постоянное напряжение.
- Анод изготавливается из метала, например, меди или платины, чтобы предотвратить его растворение при электролизе. В результате этого процесса формируется кислородный катод и имеет место Менделеево неоднократное сжигание топлива.
- Для получения чистого кислорода, полученного в процессе электролиза, требуется специально разработанное оборудование.
Таким образом, электролиз водных растворов солей оксидов кислорода, таких как перманганат калия, позволяет получить кислород. Это является важным способом получения кислорода в промышленности.
Получение кислорода электролизом

Электролиз – это процесс разложения вещества под воздействием электрического тока. Кислород можно получить электролизом воды или электролитическим разложением оксидов.
Для получения кислорода электролизом воды необходимо использовать раствор электролита, такого как серная кислота или щелочь. При подаче электрического тока на электроды, происходит разложение воды на водород и кислород.
Вода разлагается таким образом, что на катоде (отрицательный электрод) образуется водород, а на аноде (положительный электрод) образуется кислород.
Уравнение реакции электролиза воды можно записать следующим образом:
- На катоде: 2Н2O + 4е- -> 2H2O + 4Н+ + 4е- -> 2Н2↑ + 4OH-
- На аноде: 4OH- -> 2H2O + O2↑ + 4е-
Таким образом, при электролизе воды на катоде образуется водород, а на аноде – кислород. Кислород в виде газа выделяется и можно собрать в отдельную емкость.
Электролитическое разложение оксидов также может использоваться для получения кислорода. Для этого необходимо провести электролиз расплавленных оксидов металлов, таких как оксид меди или оксид свинца. При данном процессе на положительном электроде (аноде) образуется кислород.
Натрий

Натрий – химический элемент с атомным номером 11 и символом Na. Он относится к группе щелочных металлов и является одним из наиболее распространенных элементов на Земле. Натрий обладает серебристо-белым цветом и мягкой, хорошо обрабатываемой металлической текстурой.
Водные растворы натрия, такие как NaCl или натрия хлорид, широко используются в пищевой промышленности для консервации и улучшения вкусовых качеств продуктов. Натрий также находит применение в стекольной промышленности, где он используется для придания прозрачности и прочности стекла.
Процесс электролиза водных растворов натриевых солей применяется для получения чистого натрия. В ходе электролиза водород выделяется на катоде, а натрий перемещается к аноду и осаждается в виде металлической фольги. Полученный натрий используется в производстве цветных сплавов, пиротехнических смесей, а также в составе различных сплавов для легирования других металлов.
Благодаря своим физическим и химическим свойствам натрий является важным элементом в множестве промышленных и научных отраслей. Его электролиз водных растворов солей позволяет получить чистый металл, который находит широкое применение в различных областях человеческой деятельности.
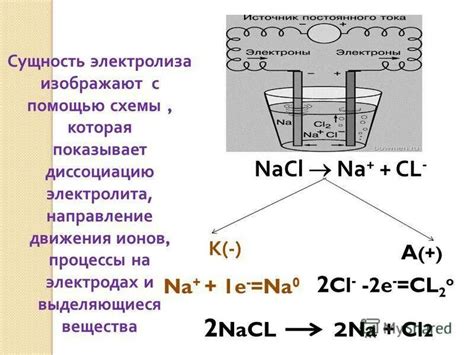
Электролиз водных растворов соли натрия

Электролиз водных растворов соли натрия является одним из примеров промышленного процесса получения металлов электролизом. Соль натрия, или кухонная соль, химическое обозначение которой NaCl, представляет собой хлорид натрия - бинарное соединение между металлом натрием и неметаллом хлором.
При электролизе водного раствора соли натрия на аноде происходит окисление ионов хлора, их электроны переносятся в анод и образуется газообразный хлор. На катоде происходит восстановление ионов натрия, электроны передаются на катод и образуется металлический натрий в виде осадка.
Электролиз соли натрия является важным процессом для получения чистого хлора и натрия, которые имеют широкое применение в промышленности и бытовых нуждах. Хлор используется в производстве пластмасс, химической промышленности, а также для обеззараживания воды. Натрий находит применение в металлургии, производстве стекла, средствах пищевой промышленности.
Железо

Железо – металл, получаемый электролизом водных растворов его солей. Этот метод довольно распространен и используется для получения железа из руды.
Наиболее часто применяемые растворы для электролиза железа это гидроксиды и сульфаты железа. Гидроксид железа, Fe(OH)2, является прекурсором для получения Fe(OH)3, который в последствии обрабатывается в водном растворе серной кислоты для получения сульфата железа, FeSO4.
Электролиз железа происходит в кислом растворе, поэтому на аноде образуется кислород, а на катоде осаждается металлическое железо. Отдельные кристаллы железа, полученные при электролизе, объединяются в крупные слои и из них изготавливают готовую продукцию, такую как проволоку, листы, трубы, балки и другие металлические детали.
Полученное железо имеет широкое применение в различных сферах, таких как производство строительных материалов, производство автомобилей, машиностроение, энергетика и другие.
Электролиз растворов солей железа

Электролиз растворов солей железа является важной технологической операцией для получения металла. Железо, находящееся в составе водных растворов его солей, может быть извлечено путем электролиза.
Данная процедура осуществляется с использованием электролита, содержащего раствор соли железа. В процессе электролиза происходит разложение соли на ионы, которые мигрируют к электродам под действием электрического тока.
На положительном электроде anode происходит окисление анионов, в то время как на отрицательном электроде cathode происходит восстановление катионов. В результате окислительно-восстановительных реакций происходит образование металла железа на отрицательном электроде.
Итак, электролиз растворов солей железа позволяет получать металл железа не только в лабораторных условиях, но и в промышленном масштабе. Данная технология имеет большое значение в металлургии и позволяет получать качественный металл железа для дальнейшего использования в различных отраслях промышленности.
Значительная доля железа в мире производится именно с использованием электролиза солей железа. Процесс электролиза растворов солей железа требует точной регулировки параметров, таких как температура, концентрация, плотность тока и других факторов, чтобы получить максимальное количество и доброкачественное железо.
Медь

Медь — один из наиболее широко используемых металлов, получаемых электролизом водных растворов его солей. Его отличает высокая электропроводность, химическая стабильность и устойчивость к коррозии. Медь обладает красно-коричневым цветом и является достаточно мягким металлом.
Медь получают электролизом растворов ее солей, например, сульфата или нитрата. При этом, в растворе образуется газовый продукт, а на катоде осаждается металлическая медь. Этот процесс позволяет получать медь с высокой степенью чистоты и требуемыми физическими свойствами.
Медь широко используется в промышленности, особенно в производстве проводников электрического тока, кабелей, электродов. Также медь применяется в строительстве, при производстве монет, украшений, а также в архитектуре и скульптуре. Благодаря своей высокой электропроводности, медь является одним из ключевых материалов в электронной промышленности.
Медь также используется в медицине, например, в виде имплантатов и медицинских инструментов, благодаря своим антимикробным и антибактериальным свойствам. Она также играет важную роль в питании человека, поскольку является необходимым микроэлементом для нормального функционирования организма.
Получение меди путем электролиза
Медь является одним из металлов, которые можно получить путем электролиза водных растворов их солей. Она обладает высокой электропроводностью и является необходимым материалом для производства различных металлических изделий.
Для получения меди путем электролиза, необходимо использовать раствор соли меди. Например, можно использовать раствор сернокислой меди (CuSO4), который предварительно разбавляется в воде.
Для электролиза раствора медной соли, необходимо подготовить анод и катод. Анодом служит обычно медная пластинка или проволока, а катодом может быть металлическая пластина или проволока из немедных материалов, таких как сталь или платина.
Во время электролиза, под влиянием электрического тока, ионы меди (Cu2+) с анода перемещаются к катоду и превращаются в атомы меди (Cu). На катоде наблюдается осаждение меди.
После окончания электролиза, на катоде образуется слой меди, который можно снять и использовать для производства различных изделий из меди.
Вопрос-ответ

Какие металлы можно получить путем электролиза водных растворов их солей?
Путем электролиза водных растворов их солей можно получить такие металлы, как медь, никель, цинк, свинец и другие.
Как происходит процесс электролиза водных растворов металлических солей?
При электролизе водных растворов металлических солей электрический ток приводит к разложению соли на металл и кислород. Металл осаждают на отрицательном электроде (катоде), а кислород выделяется на положительном электроде (аноде).
Какие факторы влияют на скорость процесса электролиза водных растворов металлических солей?
Скорость процесса электролиза водных растворов металлических солей зависит от таких факторов, как температура раствора, концентрация соли, плотность тока, приложенное напряжение и электроды.
