Металлы – это химические элементы, которые обладают определенными физическими и химическими свойствами. Они являются одной из основных групп элементов в периодической системе Д.И. Менделеева. Основываясь на структуре атомов металлов подгрупп таблицы, можно получить представление о их свойствах и поведении.
Атомы металлов в основном имеют простую структуру, характеризующуюся наличием внешней электронной оболочки, состоящей из от одного до трех электронов. Это позволяет металлам образовывать ионы положительного заряда и обладать хорошей проводимостью электричества и тепла. Кроме того, наличие слабо связанных электорнов в валентной оболочке даёт металлам высокую пластичность и способность легко поддаваться деформации.
Строение атомов металлов подгрупп таблицы также определяет их химическую активность. Благодаря большому размеру и низкой энергии ионизации, металлы легко теряют электроны и образуют положительные ионы. Они также обладают способностью образовывать межатомные связи, что позволяет им образовывать кристаллическую структуру и составлять различные соединения с другими элементами.
Понятие об атомах металлов

Атомы металлов представляют собой основные строительные блоки, из которых состоят металлы. Металлы – это химические элементы, характеризующиеся особыми физическими и химическими свойствами.
Атомы металлов характеризуются наличием металлической связи, которая обеспечивает их способность к проводимости электричества и тепла, а также их механическую прочность. Металлы преимущественно находятся в левой части периодической таблицы химических элементов и могут быть разделены на две основные группы: щелочные металлы и щелочноземельные металлы.
Атомы металлов имеют определенную структуру. В центре атома находится ядро, состоящее из протонов и нейтронов. Вокруг ядра вращаются электроны, образуя электронные оболочки. Оболочки расположены на определенных энергетических уровнях, к которым они принадлежат.
Количество энергетических уровней и количество электронов на каждом уровне зависит от атомного номера элемента и его положения в таблице Менделеева. Наиболее близким к ядру находится первая электронная оболочка, на которой может находиться всего 2 электрона. Вторая оболочка может вмещать до 8 электронов.
Структура атома металлов
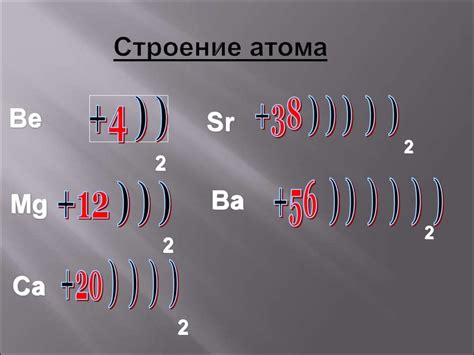
Атомы металлов имеют уникальную структуру, отличающуюся от других элементов периодической таблицы. Эта структура определяет основные свойства металлов, такие как проводимость электричества и тепла, пластичность и твердость.
Атом металла состоит из электронной оболочки и ядра. Ядро атома содержит протоны и нейтроны, а электронная оболочка - электроны. Внешний слой электронной оболочки называется валентной оболочкой, и именно ее свойства определяют химическую активность металлов.
Структура атома металла также включает особую структуру ядра. Протоны и нейтроны сгруппированы вместе в центре ядра, образуя ядерные оболочки. Ядро атома очень плотное и состоит главным образом из протонов, нейтроны несколько легче и находятся в меньшем количестве.
Электроны валентной оболочки находятся на определенных энергетических уровнях, которые организованы в подуровни и орбитали. Иногда энергетический уровень называют энергетической оболочкой. Электроны внешней оболочки металлов легко могут участвовать в химических реакциях и образовывать связи с другими атомами, что объясняет их высокую химическую активность.
В целом, структура атома металлов является сложным и организованным, что обусловливает их уникальные свойства. Понимание этой структуры позволяет лучше понять поведение металлов в химических реакциях и использовать их для получения материалов с требуемыми свойствами.
Распределение электронов в атоме металлов
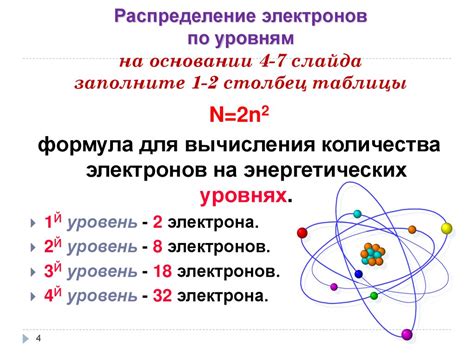
Электроны в атоме металлов распределены по энергетическим уровням и оболочкам. Каждая оболочка атома может содержать определенное количество электронов, которые занимают свои собственные орбитали. Распределение электронов определяет химические и физические свойства металлов.
Наиболее близкие к ядру оболочки называются внутренними, а наиболее удаленные – внешними. Внешняя оболочка, называемая также валентной оболочкой, обладает наибольшей энергией и определяет химическую активность атома металла. Число электронов в валентной оболочке также определяет валентность металла.
Распределение электронов в атоме металла может быть описано при помощи электронной конфигурации. Электронная конфигурация атома показывает, на каких энергетических уровнях и в каких подуровнях находятся все электроны. Иногда для удобства электронная конфигурация записывается в сокращенной форме с использованием схемы "ящиков" или обозначений с уровнями и подуровнями. Например, электронная конфигурация атома железа (Fe) может быть записана как 1s2 2s2 2p6 3s2 3p6 4s2 3d6.
Распределение электронов в атоме металла имеет огромное значение для его свойств и поведения в химических реакциях. Валентные электроны, находящиеся на внешних энергетических уровнях, участвуют в связывании с другими атомами, образуя химические связи и создавая структуру кристаллической решетки металла. Электроны внутренних оболочек образуют ядро атома, обеспечивают его структуру и стабильность.
Электронная оболочка атома металлов
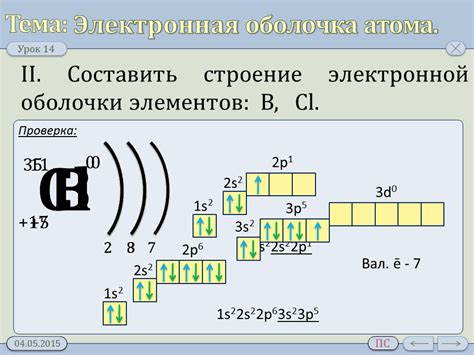
Электронная оболочка атома является важной составляющей его строения и определяет его химические свойства. У атомов металлов оболочка состоит из нескольких энергетических уровней, на которых располагаются электроны. Количество электронов в оболочке атома металла определяется его порядковым номером в таблице Менделеева.
Наиболее внешний уровень, называемый валентным, играет особую роль в химических реакциях. Обычно на валентном уровне находится от одного до четырех электронов, но в некоторых случаях их количество может быть больше. Именно эти электроны взаимодействуют со средой и определяют химическую активность атома металла. Чем меньше электронов на валентном уровне, тем больше металл проявляет металлические свойства, такие как хорошая электропроводность и теплопроводность.
Металлы могут образовывать ионы положительной заряды, отдавая один или несколько электронов с валентного уровня. При этом они становятся более стабильными и приобретают положительный заряд. Число отданных электронов равно числу зарядов иона. Например, кальций (Ca) имеет электронную конфигурацию 2, 8, 8, 2. При образовании иона Ca2+ он отдает два электрона и его электронная конфигурация становится 2, 8, 8.
Таким образом, электронная оболочка атома металлов играет важную роль в их химических свойствах и взаимодействии с другими веществами. Понимание этого позволяет объяснить различные физические и химические свойства металлов, а также использовать их в различных отраслях науки и промышленности.
Ядро атома металлов
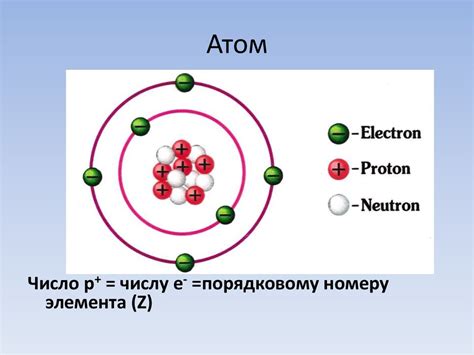
Ядро атома металлов – это центральная часть атома, которая содержит протоны и нейтроны. Протоны – это элементарные частицы с положительным зарядом, а нейтроны – нейтральные частицы. Ядро является наименьшей и наиболее плотной частью атома.
Массовое число атома металла определяется количеством протонов и нейтронов в ядре. Протоны и нейтроны имеют почти одинаковую массу, поэтому массовое число является суммой количества протонов и нейтронов в ядре атома.
В ядре атома металла протоны располагаются на одном уровне энергии и сильно взаимодействуют друг с другом. Нейтроны помогают смягчить это взаимодействие, так как они не имеют заряда и не отталкиваются друг от друга.
Металлы могут иметь различное количество протонов и нейтронов в ядре атома, что определяет их химические свойства и массовое число. Некоторые металлы имеют равное количество протонов и нейтронов в ядре, как, например, атом меди с 29 протонами и 29 нейтронами. Другие металлы могут иметь различное количество протонов и нейтронов, что ведет к возникновению изотопов с разными массами.
Ядро атома металлов невидимо для нас, однако его свойства и структура имеют огромное значение для физических и химических свойств металлов. Изучение ядра атомов металлов помогает нам понять многое о свойствах и поведении металлов, что имеет практическое значение в различных областях науки и техники.
Электроны в атоме металлов
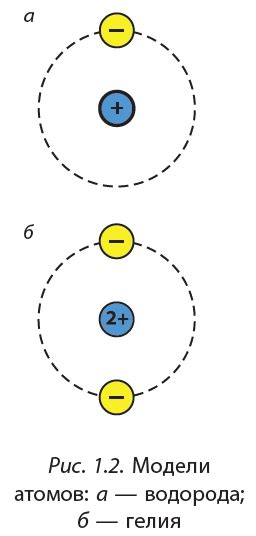
Атом металла состоит из ядра, которое содержит положительно заряженные протоны и нейтроны, и облака электронов. Количество электронов в атоме определяется его атомным номером и равно числу протонов в ядре. Электроны располагаются в атоме по энергетическим уровням и подуровням.
Распределение электронов в атоме металла может быть представлено в виде электронной конфигурации. Электронная конфигурация показывает, сколько электронов находится на каждом уровне и подуровне. Например, электронная конфигурация атома железа (Fe) равна 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Это означает, что на первом уровне находятся 2 электрона, на втором уровне 8 электронов и так далее.
Уровни и подуровни энергии в атоме заполняются электронами согласно принципу заполнения. Согласно этому принципу, электроны заполняют подуровни по очереди, начиная с наименьшей энергии. Например, в атоме металла первыми заполняются подуровни s и p, а затем подуровни d и f.
Внешний уровень электронов в атоме металла называется валентным уровнем. Валентные электроны играют ключевую роль в химических свойствах металлов. Они определяют способность металла вступать в химические реакции и образовывать соединения с другими элементами. Валентные электроны обычно находятся на подуровнях s и p.
Особенности строения атомов металлов подгрупп таблицы

Металлы подгрупп таблицы характеризуются определенными особенностями строения своих атомов. Одной из основных особенностей является наличие внешней электронной оболочки нескольких электронов, что делает эти металлы химически активными.
Атомы металлов подгрупп таблицы обычно имеют положительный заряд ядра, так как количество протонов превышает количество электронов. Это делает их способными к образованию ионов положительного заряда при взаимодействии с другими атомами и молекулами.
Кроме того, атомы металлов подгрупп таблицы обладают высокой электропроводностью, что связано с особенностями их электронной структуры. У них есть так называемая "свободная" электронная оболочка, состоящая из внешних электронов, которые легко передвигаются по материалу металла.
Строение атомов металлов подгрупп таблицы также обуславливает их способность к образованию кристаллической решетки. Атомы металлов в кристаллическом веществе формируют упорядоченную структуру, где каждый атом занимает определенное положение и связан с соседними атомами. Это придает металлам свойства прочности и пластичности.
Вопрос-ответ

Каково строение атомов металлов подгрупп таблицы?
Строение атомов металлов подгрупп таблицы определяется электронной конфигурацией их электронных оболочек. В металлах подгруппы таблицы химических элементов наружные электронные оболочки имеют от одного до трех электронов.
Какие электронные оболочки может иметь атом металла подгруппы таблицы?
Атомы металлов подгрупп таблицы могут иметь наружные электронные оболочки с 1, 2 или 3 электронами.
Какие свойства имеют атомы металлов подгруппы таблицы с наружной электронной оболочкой, содержащей 1 электрон?
Атомы металлов подгруппы таблицы с наружной электронной оболочкой, содержащей 1 электрон, имеют свойство легко отдавать этот электрон и образовывать ионы положительного заряда.
В чем заключается особенность наружной электронной оболочки атомов металлов подгруппы таблицы с наибольшим числом электронов (3)?
Особенностью наружной электронной оболочки атомов металлов подгруппы таблицы с наибольшим числом электронов (3) является наличие этих электронов в p-орбиталях, что влияет на их химические свойства и способность образовывать соединения с другими элементами.
