Атом является основным строительным блоком вещества и имеет сложную структуру. Он состоит из ядра и облака электронов. Ядро, в свою очередь, состоит из протонов и нейтронов, которые называются нуклонами. Протоны имеют положительный заряд, а нейтроны являются электрически нейтральными. Облако электронов окружает ядро и содержит электроны, отрицательно заряженные элементарные частицы.
Металлы побочных групп таблицы Менделеева, такие как медь, цинк, кобальт и другие, имеют свои особенности, связанные с атомным строением. В атомах этих металлов количество протонов и электронов может быть разным, что приводит к возникновению их различной химической активности и свойств. Это подтверждается тем, что эти металлы образуют разнообразные соединения и обладают различными химическими и физическими свойствами.
Например, металлы побочных групп обычно обладают высокой электропроводностью и теплопроводностью, что связано с наличием свободных электронов в их атомах. Эти электроны могут легко передвигаться внутри металла и обеспечивают передачу электрического и теплового тока. Также металлы побочных групп могут образовывать сплавы с другими металлами, что делает их особенно ценными в промышленности.
Изучение строения атомов металлов побочных групп позволяет лучше понять их химические и физические свойства. Благодаря этому знанию, инженеры и ученые могут разрабатывать новые материалы на основе этих металлов, которые обладают необходимыми для различных отраслей промышленности свойствами.
Строение атома и его элементы
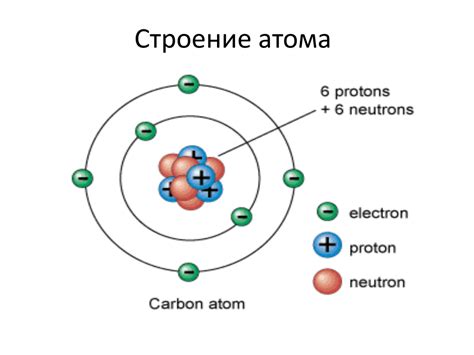
Атом - это наименьшая частица вещества, обладающая его свойствами. Он состоит из ядра и электронной оболочки. Ядро атома содержит протоны и нейтроны, а электронная оболочка состоит из электронов.
Протоны - это частицы с положительным зарядом, которые находятся в ядре атома. У каждого элемента определенное количество протонов, которое называется атомным номером и определяет его положение в периодической системе.
Нейтроны - это частицы без заряда, которые также находятся в ядре атома. Они способны удерживать протоны внутри ядра благодаря силе притяжения.
Электроны - это частицы с отрицательным зарядом, которые обращаются вокруг ядра на электронных оболочках. Они обладают очень малой массой и отвечают за химические свойства элемента.
Основополагающим законом взаимодействия атомов является закон электростатики. Протоны, имеющие положительный заряд, притягивают электроны, имеющие отрицательный заряд, и таким образом удерживают их на оболочке. Это делает атом стабильным.
Таким образом, строение атома и его элементы определяют его физические и химические свойства. Количество протонов и электронов в атоме определяет его заряд и расположение в периодической системе.
Атом: структура и основные составляющие
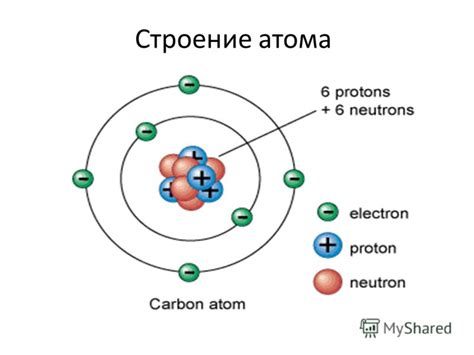
Атом - это минимальная частица вещества, обладающая его свойствами. Он состоит из трех основных частиц: протонов, нейтронов и электронов. Протоны имеют положительный заряд, нейтроны не имеют заряда, а электроны обладают отрицательным зарядом.
Протоны и нейтроны находятся в ядре атома, которое находится в его центре. Протоны определяют элемент и его атомный номер, а нейтроны обеспечивают стабильность ядра. Заряд ядра равен суммарному заряду протонов.
Электроны находятся вокруг ядра и образуют электронные оболочки. Количество электронов в атоме равно количеству протонов, чтобы обеспечить нейтральность атома. Электроны распределены по энергетическим уровням и подуровням в оболочках. На каждом уровне может находиться определенное количество электронов.
Структура атома может быть представлена в виде электронной конфигурации, которая описывает расположение и количество электронов в каждом энергетическом уровне и подуровне. Электронная конфигурация позволяет определить свойства элемента и взаимодействие атомов при образовании химических соединений.
В заключение, атом - это сложная система со своей уникальной структурой. Протоны и нейтроны находятся в центральном ядре, а электроны расположены вокруг ядра. Электронная конфигурация определяет свойства и поведение атома в химических реакциях. Понимание строения атома позволяет лучше понять основы химии и взаимодействие веществ.
Электронные уровни и электронная конфигурация атома
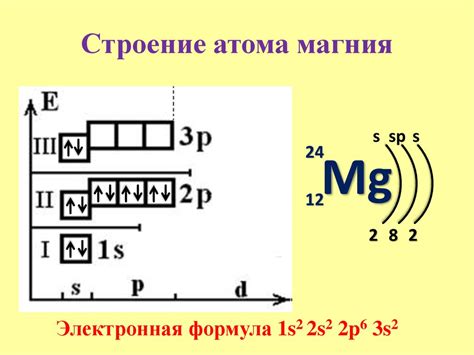
Атом состоит из ядра и электронной оболочки. Электронная оболочка атома содержит электроны, которые распределены по электронным уровням. Всего существует несколько электронных уровней, каждый из которых может вмещать определенное количество электронов.
Распределение электронов по электронным уровням определяется электронной конфигурацией атома. Электронная конфигурация атома описывается с помощью нотации, в которой указывается количество электронов на каждом электронном уровне. Например, электронная конфигурация атома кислорода (O) выглядит следующим образом: 1s² 2s² 2p⁴.
Первый электронный уровень, обозначаемый буквой s, может вмещать до 2 электронов. Второй электронный уровень, также обозначаемый буквой s, также может вмещать до 2 электронов. Второй уровень также имеет дополнительные электронные подуровни p, d и f, каждый из которых может вместить определенное количество электронов.
Электронные уровни и электронная конфигурация атома имеют важное значение для понимания свойств элементов. Они влияют на химическую активность и способность элемента образовывать соединения, а также его физические свойства, такие как плотность, температура плавления и кипения.
Особенности металлов побочных групп

Металлы побочных групп – это элементы, расположенные в таблице химических элементов между металлами основной группы и полуметаллами. Они обладают своеобразными свойствами, которые отличают их от других металлов и придают им промышленную значимость.
Побочные группы металлов включают в себя такие элементы, как алюминий, цинк, кадмий, олово и свинец. Они имеют низкую плотность, высокую пластичность и хорошую коррозионную стойкость. Благодаря этим свойствам они широко используются в производстве различных изделий, включая легкие конструкции, автомобили, космические корабли и упаковочные материалы.
Одной из основных особенностей металлов побочных групп является их большая химическая активность. Они легко вступают во множество химических реакций и образуют различные соединения. Кроме того, они обладают хорошими проводимостью тепла и электричества, что делает их незаменимыми материалами для производства электронных устройств и проводников.
Металлы побочных групп также обладают высокой температурой плавления и кипения, что делает их идеальными материалами для использования в высокотемпературных процессах. Они также характеризуются способностью образовывать сплавы с другими металлами, что позволяет создавать материалы с желаемыми механическими и химическими свойствами.
Металлы побочных групп играют важную роль в современной промышленности и науке. Их уникальные свойства исключительно важны для разработки новых материалов и технологий, а также для решения различных инженерных задач и создания устойчивой и экологически безопасной среды.
Вопрос-ответ

Каково строение атома и особенности металлов побочных групп?
Атом состоит из ядра, в котором находятся протоны и нейтроны, а также электронной оболочки, на которой находятся электроны. Основные особенности металлов побочных групп заключаются в их химических свойствах: они обладают высокой электропроводностью, теплопроводностью, пластичностью и металлическим блеском. Кроме того, металлы побочных групп имеют низкую электроотрицательность и склонность образовывать ионы положительного заряда.
Какие элементы относятся к металлам побочных групп?
Металлы побочных групп - это элементы, которые находятся в двух группах таблицы Менделеева: с переходными и постпереходными элементами. К переходным элементам относятся металлы из диапазона блоков d и f в таблице Менделеева (например, железо, медь, цинк), а постпереходные элементы находятся в блоках p и d (например, галлий, индий, олово).
Каковы свойства металлов побочных групп, отличающие их от других металлов?
Основные свойства металлов побочных групп, отличающие их от других металлов, заключаются в их более сложной электронной структуре и наличии различных подуровней энергии. Это приводит к более широкому спектру химических и физических свойств, по сравнению с основными или щелочными металлами. Кроме того, металлы побочных групп обладают высокой плотностью и тугоплавкостью, а некоторые из них обладают свойствами полупроводников.
Какова роль металлов побочных групп в технике и промышленности?
Металлы побочных групп играют важную роль в технике и промышленности. Они используются в производстве различных материалов, таких как сталь, алюминий, медь и многое другое. Кроме того, металлы побочных групп находят применение в электронике, машиностроении, автомобильной и авиационной промышленности, а также в производстве батарей, солнечных элементов, магнитов и других изделий.
