Металлы являются одним из наиболее важных типов электролитов. Электролиты - это вещества, способные проводить электрический ток. В качестве электролитов часто используются растворы солей и кислот, но металлы также обладают этим свойством.
Одной из ключевых особенностей металлов как электролитов является их способность отдавать электроны, образуя положительно заряженные ионы металла. Это происходит благодаря особенностям строения металлической решетки, в которой электроны свободно передвигаются между атомами. Под действием электродного потенциала металлы становятся источниками электронов для других реакций.
Еще одной важной особенностью металлов как электролитов является их способность к проявлению гальванической коррозии. Коррозия - процесс разрушения металла в результате химической реакции с окружающей средой. В случае металлов, если встречаются различные металлы, то один из них может выступать в роли анода, а другой - в роли катода. При наличии электролита между этими двумя металлами возникает гальваническая коррозия, которая приводит к разрушению одного из металлов.
Металлы как электролиты играют важную роль в различных областях. Они используются в батареях и аккумуляторах, гальванических элементах, электрохимических процессах и других технологиях. Понимание особенностей металлов как электролитов помогает улучшать эффективность этих процессов и разрабатывать новые материалы и устройства.
Проводники ионов: металлические решетки

Металлические решетки являются примером проводников ионов, где положительно заряженные ионы располагаются в кристаллической структуре. Металлы состоят из положительных ионов ядра и свободно движущихся электронов, которые отвечают за проводимость электричества.
Металлические решетки обладают своими особенностями. Внутри решетки ионы располагаются в регулярном порядке, образуя кристаллическую структуру. Заряды ионов притягивают друг друга, образуя внутренние силы, которые обеспечивают прочность и устойчивость решетки.
Свободные электроны, находящиеся между ионами, могут перемещаться под воздействием внешнего электрического поля. Это обуславливает хорошую проводимость металлов. Электроны двигаются по металлической решетке, сталкиваясь с ионами и рассеиваясь на них. Это вызывает явление сопротивления, которое зависит от концентрации ионов в решетке.
Из-за наличия свободных электронов, металлические решетки обладают высокой теплопроводностью и электропроводностью. Это делает металлы полезными в различных областях, включая электротехнику, машиностроение и другие.
Катоды и аноды: влияние металлов на процессы электролиза
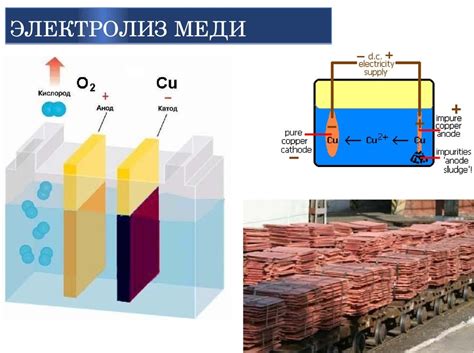
Катоды и аноды - важные элементы в процессе электролиза, при котором вещественные соединения разлагаются под воздействием электрического тока. Катод - это электрод, на который переносятся положительно заряженные ионы, а анод - электрод, на который переносятся отрицательно заряженные ионы.
Металлы, используемые в качестве катодов и анодов, оказывают значительное влияние на процессы электролиза.
Катоды могут быть сделаны из различных металлов, таких как железо, медь, никель и другие. При погружении в раствор ионов металла катод притягивает положительные ионы и становится местом их осаждения, то есть формирует металлическое соединение. Катод из разных металлов может создавать различные продукты электролиза.
Аноды также могут быть сделаны из различных металлов, например, свинца, титана, платины и т.д. При электролизе на аноде происходит окисление, то есть образование положительно заряженных ионов на его поверхности. Анод из разных металлов может влиять на скорость окисления и, следовательно, на процесс электролиза в целом.
Таким образом, выбор металла для катода и анода является важным аспектом процесса электролиза и может существенно влиять на его эффективность и результаты.
Реакции окисления-восстановления: уникальные свойства металлов

Металлы обладают уникальными свойствами, которые позволяют им активно участвовать в реакциях окисления-восстановления. Такие реакции, при которых одно вещество окисляется, а другое восстанавливается, являются основой множества химических процессов.
Важным свойством металлов является их способность отдавать электроны при окислении. Металлы способны образовывать ионные соединения, где они выступают в роли катионов. При этом металлы выполняют функцию электролитов и могут участвовать в электролизе.
Металлы также способны активно взаимодействовать с кислородом, что приводит к образованию оксидов металлов. Восстановление оксидов металлов обеспечивает энергию для многих химических процессов, в том числе для работы электрохимических элементов и аккумуляторов.
Способность металлов к окислению и восстановлению позволяет им играть важную роль в реакциях с другими веществами, например, в цепочке реакций внутри организма, в которых участвуют минералы, ферменты и другие химические соединения. Понимание этих реакций является важным шагом в изучении химических процессов и применении металлов в различных областях науки и промышленности.
Электропроводность: металлы как передающие заряды материалы

Металлы являются одними из наиболее электропроводных материалов. Они обладают способностью свободно передавать электрический заряд благодаря своей особой структуре и свойствам.
В металлической структуре атомы металла образуют кристаллическую решетку, в которой электроны между атомами свободно двигаются. Эти свободные электроны называются электронами проводимости, они способны двигаться под воздействием электрического поля.
Благодаря наличию свободных электронов, металлы обладают высокой электропроводностью. Когда к металлу прикладывается разность потенциалов (например, включается электрическое устройство), свободные электроны начинают двигаться в направлении положительного заряда. Таким образом, металлы выполняют роль электрического проводника, позволяющего току протекать от одного конца к другому.
Важно отметить, что электропроводность металлов может значительно различаться в зависимости от их химического состава и структуры. Некоторые металлы, такие как медь и алюминий, являются особенно хорошими проводниками и широко используются в электротехнике и электронике.
Тем не менее, некоторые металлы могут обладать меньшей электропроводностью из-за наличия примесей или особых структурных особенностей. Такие материалы могут быть полезны в специфических приложениях, где требуется контроль электропроводности.
В целом, электропроводность металлов является ценным свойством, которое находит широкое применение в различных областях науки и техники. Понимание особенностей электропроводности металлов позволяет эффективно использовать их в разработке новых материалов и технологий.
Потенциал окислительно-восстановительной пары: роль металлов в химических реакциях

Металлы играют важную роль в химических реакциях благодаря своей способности действовать как электролиты. Одной из важных характеристик, определяющей реакционную способность металлов, является их потенциал окислительно-восстановительной пары.
Потенциал окислительно-восстановительной пары (ПОВП) - это мера способности металла окисляться или восстанавливаться в электрохимической реакции. Он позволяет определить направление потока электронов в реакции и может быть положительным или отрицательным в зависимости от способности металла восстанавливаться или окисляться.
С помощью ПОВП можно установить, какой металл обладает большей реакционной способностью в окислительно-восстановительной паре. Если потенциал одного металла в паре положителен, а другого - отрицателен, то поток электронов будет идти от металла с более низким ПОВП к металлу с более высоким ПОВП.
Знание ПОВП металлов имеет практическое применение в различных сферах, включая электрохимическую промышленность, гальванику и аккумуляторные технологии. Металлы с высоким положительным ПОВП, такие как цинк, железо и медь, широко используются в производстве электрических элементов и аккумуляторов.
Таким образом, потенциал окислительно-восстановительной пары является важной характеристикой металлов, которая позволяет определить их реакционные способности и применение в электрохимических процессах.
Сопротивление электролитов: влияние металлов на электрическую проводимость
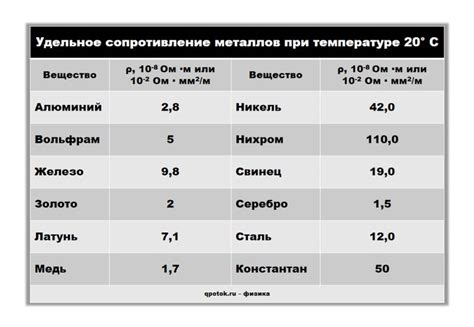
Электролиты - вещества, способные проводить электрический ток через растворы или плавящиеся соли. Они играют важную роль в различных электрохимических процессах, включая батареи, гальванические элементы и электролиз. Одной из ключевых характеристик электролитов является их электрическая проводимость.
Проводимость электролитов зависит от различных факторов, включая их состав и концентрацию растворенных ионов. Сопротивление электролита определяется величиной его проводимости. Металлы, входящие в состав электролита, оказывают существенное влияние на его электрическую проводимость.
Металлы обладают высокой проводимостью электрического тока благодаря наличию свободных электронов в их решетке. Эти свободные электроны могут легко перемещаться внутри металла, обеспечивая его электрическую проводимость. Поэтому добавление металлов в раствор электролита может значительно повысить его проводимость.
Однако, электролит может также включать в себя ионы, которые являются несколько менее подвижными, чем свободные электроны в металлах. Это может привести к увеличению сопротивления электролита и снижению его проводимости. Поэтому эффект металлов на электрическую проводимость электролита может быть двуединственным.
Коррозия: особенности поведения металлов в агрессивной среде

Коррозия является процессом разрушения металлических материалов под воздействием агрессивной среды. Металлы взаимодействуют с различными веществами, такими как кислоты, соли, влага, что приводит к их окислительно-восстановительным реакциям.
Изначально, металлы, такие как железо или алюминий, обладают электрохимической активностью, то есть способностью реагировать с окружающим веществом. При контакте с агрессивной средой, металлы могут образовывать оксидные пленки, которые могут быть защитными и предотвращать коррозию, либо, наоборот, приводить к ускоренному разрушению материала.
Основные факторы, влияющие на скорость коррозии металлов, это состав среды, температура, влажность, а также наличие ионов, которые могут служить каталитическими агентами ускорения реакции окисления. Например, вода и кислород - наиболее распространенные агенты, приводящие к коррозии многих металлов.
Для повышения стойкости металлов к коррозии используются различные методы, такие как покрытие металла защитной пленкой, например, гальваническим оцинкованием. Также используются специальные смазки, антикоррозионные покрытия и легирование металлических сплавов.
Коррозия металлов является серьезной проблемой в различных отраслях промышленности, поэтому важно проводить постоянное мониторинг состояния металлических конструкций и применять соответствующие меры по их защите от коррозии. Это позволит увеличить срок службы металлических изделий и сохранить их надежность и качество.
Гальванические элементы: использование металлов в энергетике и электротехнике

Гальванические элементы являются основой для создания электрической энергии в различных областях применения, таких как энергетика и электротехника. Один из важных компонентов гальванических элементов - металлы, которые выступают в роли электролитов.
Металлы обладают способностью проводить электрический ток и являются теми веществами, которые окисляются в гальванической ячейке. Это позволяет использовать различные металлы для создания разнообразных гальванических элементов, включающих в себя аноды и катоды.
В энергетике металлы широко используются для производства аккумуляторных батарей, которые являются источниками портативной энергии. Например, в свинцово-кислотных аккумуляторах основным металлом является свинец, который используется в роли анода. Катодом в таких аккумуляторах может быть такой металл, как свинец-сурьма.
В электротехнике металлы также широко применяются в различных устройствах. Например, в электролитических конденсаторах используются различные металлы в качестве электролита, такие как алюминий или тантал. Кроме того, в электронике активно применяются контактные материалы на основе металлов, такие как серебро или медь, для обеспечения надежных соединений и передачи электрического тока.
Таким образом, металлы играют важную роль в гальванических элементах и находят широкое применение в энергетике и электротехнике. Они обладают способностью проводить электрический ток и могут быть использованы в качестве электролитов, анодов и катодов в гальванических элементах, что делает их незаменимыми компонентами электрических устройств.
Вопрос-ответ

Какие металлы могут использоваться в качестве электролитов?
В качестве электролитов можно использовать различные металлы, такие как цинк, свинец, железо, никель, алюминий и многие другие. Выбор металла зависит от конкретной задачи и требуемых свойств электролита.
Какие особенности металлов делают их хорошими электролитами?
Металлы хорошие электролиты, так как они обладают высокой электропроводностью и электрохимической активностью. Это позволяет им эффективно протекать электрический ток и участвовать в электрохимических реакциях.
