Металлы являются одними из самых распространенных и важных материалов, используемых человеком. Они обладают высокой электропроводимостью и механической прочностью, что делает их идеальным выбором для конструкционных и электрических целей. Однако, взаимодействие металлов с окружающей средой может приводить к их коррозии или окалине, что уменьшает их долговечность и функциональную эффективность. Механизм обмена электронами между металлами и окружающей средой играет ключевую роль в этом процессе.
Обмен электронами между металлом и окружающей средой происходит вследствие перехода электронов между атомами металла и молекулами вещества, с которым он в контакте. Данный процесс может быть вызван различными факторами, включая наличие кислорода, влаги, кислот, щелочей и других агрессивных веществ. В результате этого происходит окисление металла, влекущее за собой разрушение его структуры и свойств.
Основные физико-химические процессы, происходящие при обмене электронами между металлами и окружающей средой, включают анодную и катодную реакции. Во время анодной реакции металл отдает электроны, окисляется и образует ионы в среде. В то же время, во время катодной реакции, происходит приём электронов и восстановление металла.
Механизм обмена электронами между металлами и окружающей средой может быть усилен или ослаблен различными факторами, такими как температура, влажность, состав среды и покрытие поверхности металла. Понимание этого механизма является крайне важным для разработки эффективных методов защиты от коррозии и повышения долговечности металлических конструкций и изделий.
Роль металлов в окружающей среде

Металлы являются важной частью окружающей среды и неотъемлемой частью нашей жизни. Они выполняют различные роли и функции, влияют на живые организмы и окружающую среду в целом.
Первая роль металлов - это их участие в биохимических процессах. Многие металлы являются необходимыми микроэлементами для жизнедеятельности организмов. Они входят в состав различных ферментов и катализаторов, участвуют в обмене веществ и регулируют работу различных систем организма.
Вторая роль металлов - это их влияние на окружающую среду и процессы в ней. Многие металлы могут оказывать токсическое действие на живые организмы, особенно при высоких концентрациях. Они могут накапливаться в почвах, воде и воздухе, вызывая загрязнение окружающей среды и вредя здоровью людей и животных.
Третья роль металлов - это их использование в различных отраслях промышленности и строительства. Металлы широко применяются в производстве различных материалов, техники, электроники и транспорта. Однако, необходимо учитывать их влияние на окружающую среду и применять меры по устранению или минимизации их отрицательного воздействия.
Четвертая роль металлов - это их участие в природных геологических процессах. Многие металлы находятся в недрах земли и попадают в окружающую среду в процессе их выноса из горных пород. Они могут оказывать влияние на формирование грунтов, рельефа и ландшафтов, а также на перемещение и концентрацию других элементов и веществ.
В целом, роль металлов в окружающей среде очень значительна. Они необходимы для жизни организмов, но при этом могут негативно влиять на окружающую среду и вызывать загрязнение. Понимание этих ролей и управление воздействием металлов на окружающую среду являются важной задачей для современного общества.
Процессы окисления и восстановления

Процессы окисления и восстановления в металлах играют важную роль в обмене электронами между металлами и окружающей средой. Когда металл взаимодействует с окружающей средой, происходит окисление, то есть процесс, при котором металл теряет электроны. В результате этого процесса металл может образовать окисные слои, которые могут быть защитными или нежелательными для самого металла.
Процесс восстановления, наоборот, происходит, когда металл восстанавливает электроны, которые он потерял в процессе окисления. Восстановление может происходить спонтанно или в результате взаимодействия металла с другими веществами.
Процессы окисления и восстановления могут происходить одновременно, особенно в присутствии окислителей и восстановителей. Окислители - это вещества, способные отбирать электроны у металла, вызывая его окисление. Восстановители, наоборот, могут отдавать электроны, способствуя восстановлению металла.
Важно отметить, что процессы окисления и восстановления влияют на свойства металлов, их коррозионную стойкость и способность сохранять свою форму и функциональность в окружающей среде. Понимание этих процессов позволяет разработать методы защиты от коррозии и улучшить долговечность металлических изделий и конструкций.
Электронный обмен в жидкой среде

Электронный обмен между металлами и окружающей средой играет важную роль при рассмотрении их коррозии. В жидкой среде процессы обмена электронами происходят динамично и воздействуют на поверхность металла, вызывая его разрушение и изменение свойств.
Влияние жидкой среды на электронный обмен обусловлено наличием в ней растворенных веществ. Они могут быть окислителями или восстановителями, способными ускорять или замедлять химические реакции обмена электронами. Реакции происходят на поверхности металла, где происходит переход электронов между металлом и окружающей средой.
Вода, например, содержит растворенный кислород, который является сильным окислителем. Это позволяет ей эффективно взаимодействовать с металлом, вызывая окислительное разрушение его поверхности. Однако взаимодействие между металлом и жидкой средой зависит не только от концентрации окислителей, но и от других факторов, таких как рН среды и температура.
Взаимодействие между металлом и окружающей средой в жидкой форме может быть представлено в виде электрохимической реакции, которая можно описать с помощью электродов. Металл выступает в роли анода, где происходит окисление, а окружающая среда - в роли катода, где происходит восстановление. Эти процессы являются основой коррозии и могут быть связаны с различными видами электролитов, такими как морская или промышленная вода.
Электронный обмен на границе фаз

Межфазный обмен электронами является важным физическим процессом, определяющим электрические свойства материалов на границе раздела фаз. Этот процесс особенно значим в системах, содержащих металлы.
На границе фаз имеют место переходные зоны, в которых возникают изменения структуры и электронных свойств материалов. Электронная структура исходного металла и свойства окружающей среды приводят к тому, что электроны на границе фаз могут переходить из одного материала в другой.
Важно отметить, что электронный обмен на границе фаз может приводить к изменению электрической проводимости материала. При этом возникают поверхностные состояния, которые могут быть различными по энергии и спину. Эти состояния играют значительную роль в проницаемости границы фаз и могут оказывать влияние на использование материала в различных электронных устройствах.
Электронный обмен на границе фаз может быть управляем с помощью внешних факторов, таких как температура, влажность, давление и т. д. При изменении этих параметров меняется энергия переходного состояния и, следовательно, электронный обмен может изменяться. Это открывает возможности для контроля и регулирования электрических свойств материалов на границе фаз.
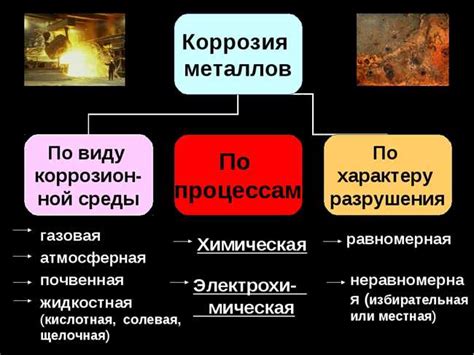
Окисление и коррозия металлов

Окисление и коррозия металлов являются процессами, в результате которых металлы подвергаются разрушению или изменению своих химических свойств из-за воздействия окружающей среды. Окисление - это химическая реакция, в результате которой металл соединяется с кислородом, образуя оксид. Коррозия - это процесс разрушения металла под воздействием химических реакций с окружающей средой.
Окисление металлов происходит во влажной среде, так как вода содержит кислород и может служить окислителем. Оксиды, образующиеся в результате окисления, обычно обладают очень низкой степенью растворимости, что приводит к образованию слоя пассивной пленки на поверхности металла. Пассивная пленка защищает металл от дальнейшего окисления.
Однако, если пассивная пленка повреждается или разрушается, то металл становится уязвимым перед окружающей средой и начинает претерпевать коррозию. Коррозия провоцируется наличием вредных веществ в воздухе или воде, таких как соли, кислоты или щелочи. Коррозия может привести к изменению физической структуры металла, образованию трещин и даже полному разрушению.
Для защиты металлов от окисления и коррозии применяют различные методы, такие как покрытие металла защитным слоем, использование антикоррозийных добавок, контроль окружающей среды и регулярное обслуживание и очистка металлических поверхностей. Это позволяет продлить срок эксплуатации металла и сохранить его функциональность и эстетический вид.
Влияние окружающей среды на коррозию

Окружающая среда играет ключевую роль в процессе коррозии металлов. Различные физические и химические факторы окружающей среды могут ускорить или замедлить процесс коррозии. Особенно важными факторами являются температура, влажность и наличие агрессивных химических веществ.
Высокая температура окружающей среды может ускорить коррозию металлов. Вследствие нагрева металл может окисляться и выделять определенные химические вещества, которые способствуют процессу коррозии. Особенно вредными в этом отношении являются высокие температуры в сочетании с повышенной влажностью.
Влажность также является важным фактором, влияющим на коррозию металлов. Высокая влажность окружающей среды способствует образованию коррозионных пленок на поверхности металла и ускоряет процесс разрушения. Кроме того, влажность способствует диффузии кислорода и других агрессивных веществ к поверхности металла, усиливая коррозию.
Наличие агрессивных химических веществ в окружающей среде также может значительно ускорить процесс коррозии. Кислоты, соли, растворители и другие химические вещества способны при небольших концентрациях вызывать интенсивное разрушение металла. Особенно опасным может быть сочетание влажности с химическими веществами, которые могут образовывать агрессивные электролиты.
Способы предотвращения коррозии
Коррозия металлов является распространенной проблемой, которая может привести к значительным повреждениям и потере функциональности металлических изделий. Однако существуют различные способы предотвратить коррозию и увеличить срок службы металлических конструкций и изделий.
- Использование противокоррозийных покрытий. Применение покрытий на поверхность металла создает защитный слой, который предотвращает контакт металла с окружающей средой. Примерами таких покрытий являются краска, эмаль, оцинковка, хромирование и другие.
- Применение антикоррозийных добавок. Добавление специальных веществ в металл или его сплав позволяет снизить скорость коррозии и увеличить его стойкость к окружающей среде. Например, добавление хрома в сталь создает пассивную пленку, которая защищает металл.
- Использование катодной защиты. Катодная защита основана на принципе подключения металла, который нужно защитить, к электрическому источнику тока. Ток создает пассивную пленку на поверхности металла, которая предотвращает коррозию.
- Регулярное обслуживание и уход за металлическими изделиями. Регулярная очистка и смазывание металлических поверхностей помогает удалять загрязнения и предотвращает образование коррозии.
- Использование нержавеющих сталей и сплавов. Нержавеющие стали и сплавы обладают высокой стойкостью к коррозии благодаря специальным добавкам, которые формируют защитную пленку на поверхности металла.
Выбор способа предотвращения коррозии зависит от характера металла, условий эксплуатации и требований к изделию. Наличие правильной защиты от коррозии помогает увеличить срок службы металлических конструкций и обеспечить их надежность и безопасность.
Вопрос-ответ

Как происходит обмен электронами между металлами и окружающей средой?
Обмен электронами между металлами и окружающей средой происходит посредством реакций окисления и восстановления. Металлы, обладающие связывающими электронами, могут отдавать или принимать электроны в реакциях с окружающей средой. Это обусловлено разностью электрохимических потенциалов между различными элементами.
Какие факторы влияют на обмен электронами между металлами и окружающей средой?
Факторы, влияющие на обмен электронами между металлами и окружающей средой, включают концентрацию растворенного кислорода и других веществ в окружающей среде, pH среды, температуру, наличие катодного и анодного вещества, поверхностные свойства металла и т. д.
Какие типы обмена электронами существуют между металлами и окружающей средой?
Существуют три основных типа обмена электронами между металлами и окружающей средой: анодный процесс, катодный процесс и диффузионный процесс. В анодном процессе металл отдает электроны в окружающую среду, в катодном процессе металл принимает электроны из окружающей среды, а в диффузионном процессе электроны перемещаются через границу раздела между металлом и окружающей средой.
Какие механизмы регулируют обмен электронами между металлами и окружающей средой?
Обмен электронами между металлами и окружающей средой регулируется несколькими механизмами, включая электрохимическую реакцию, протекающую на поверхности металла, адсорбцию и десорбцию электронов на поверхности металла, диффузию электронов через структуру металла, рекомбинацию электронов и др.
