Металлы - это одна из основных категорий химических элементов, обладающих специфическими свойствами и поведением. Одной из особенностей металлов является наличие свободно движущихся электронов во внешнем электронном слое атома. Эти внешние электроны, также называемые валентными электронами, играют важную роль в химических реакциях и определяют множество свойств металлов.
Валентные электроны в металлах обладают высокой подвижностью и могут свободно перемещаться по кристаллической решетке, образуя так называемый "электронный газ". Благодаря этому, металлы обладают высокой электропроводностью и теплопроводностью. Кроме того, внешние электроны определяют металлический блеск, пластичность и прочность металлов.
Взаимодействие внешних электронов между собой и с окружающей средой определяет множество химических свойств металлов. Например, валентные электроны могут участвовать в обменных реакциях с другими атомами, образуя ионы. Это позволяет металлам образовывать различные химические соединения и проявлять разнообразные химические реакции, такие как окисление и восстановление.
Изучение особенностей металлов и их внешних электронов позволяет понять многие аспекты химии и применить этот знания в различных областях, включая технологии, энергетику и медицину.
Основные понятия и принципы

Металлы - это химические элементы, характеризующиеся высокой электропроводностью, гибкостью и блеском. В отличие от неметаллов, у металлов внешняя оболочка атома обычно содержит малое количество электронов, что обеспечивает им характерную металлическую структуру.
Внешние электроны - электроны, находящиеся во внешней электронной оболочке атома. Для металлов внешние электроны находятся на уровнях с низкой энергией, благодаря чему они могут свободно двигаться внутри металлической структуры и обеспечивать высокую электропроводность.
Энергетические уровни - дискретные значения энергии, которые могут иметь электроны в атоме. Энергетические уровни обладают определенной величиной энергии и влияют на химические свойства и поведение атомов.
Ионизация - процесс отрыва электрона от атома, который может происходить при воздействии энергии. В процессе ионизации внешние электроны могут переходить на более высокие энергетические уровни или покидать атом полностью.
Металлическая связь - тип связи между атомами в металлах, основанный на взаимодействии между положительно заряженными ионами металла и облаком свободных электронов. Металлическая связь отвечает за множество свойств металлов, включая их электропроводность, пластичность и теплопроводность.
Значение внешних электронов для химических свойств металлов
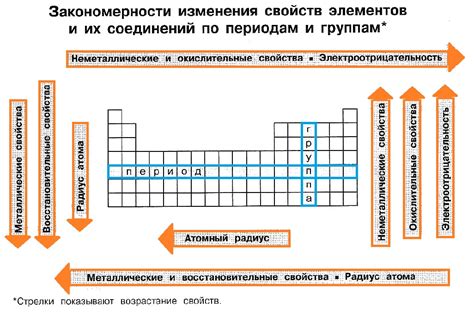
Внешние электроны влияют на химические свойства металлов, определяя их реакционную способность и способность образовывать соединения. Внешние электроны это электроны, находящиеся на самых внешних энергетических уровнях атома металла, которые отвечают за его химическую активность.
Количество внешних электронов определяет, как металл будет взаимодействовать с другими веществами. Металлы с одним или двумя внешними электронами, такими как литий или калий, обладают высокой реакционной способностью и легко образуют ионы положительного заряда, сдавая эти электроны. Они образуют соли и металлические ионы во внешней сфере.
Внешние электроны также определяют проводимость металлов. Благодаря свободным электронам, металлы обладают высокой электропроводностью. Внешние электроны образуют общий облако свободных электронов, которое может перемещаться под воздействием электрического поля.
Кроме того, взаимодействие внешних электронов с атомами других веществ определяет возможность металлов образовывать различные соединения. В реакциях с неметаллами, металлы обычно отдают электроны, образуя положительные ионы. Исключением являются металлы с низкой электроотрицательностью и высоким падением электроотрицательности по вертикали периодической системы, такие как сурьма и галлий, которые могут образовывать соединения с отрицательными ионами.
Таким образом, внешние электроны играют ключевую роль в определении химических свойств металлов, и их количество и взаимодействие с другими атомами определяют их реакционную способность, проводимость и способность образовывать соединения.
Примеры внешних электронов в химических соединениях металлов
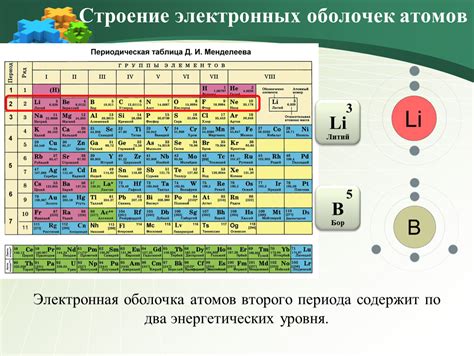
Внешние электроны в металлах играют важную роль в химических соединениях, определяя их свойства и возможности осуществления реакций.
Примером может служить связывание атомов металлов с атомами неметаллов. Например, натрий (Na) обладает одним внешним электроном, который может передаться атому хлора (Cl) для образования ионов Na+ и Cl-. Такое связывание приводит к образованию ионного соединения, в данном случае натрия хлорида (NaCl).
Другим примером может служить образование ковалентных соединений между атомами металлов и неметаллов. Например, молекула водорода (H2) состоит из двух атомов, каждый из которых обладает одним внешним электроном. Атомы водорода могут образовать ковалентную связь с атомами металлов, например, меди (Cu), что приводит к образованию соединения меди(I) гидрида (CuH).
Кроме того, металлы могут образовывать соединения с другими металлами, образуя так называемые интерметаллические соединения. Например, соединение железа (Fe) и никеля (Ni) может образовать сплав, который имеет особые механические и электрические свойства.
Вопрос-ответ

Что такое внешние электроны?
Внешние электроны - это электроны, находящиеся на самом вышележащем энергетическом уровне атома металла. Они участвуют в химических реакциях и обеспечивают электропроводность металлов.
Какие свойства обладают металлы?
Металлы обладают несколькими характерными свойствами. Они обладают высокой тепло- и электропроводностью, металлическим блеском, пластичностью и твердостью. Кроме того, металлы способны образовывать сплавы и обладают высокой плотностью.
Как внешние электроны влияют на химические свойства металлов?
Внешние электроны определяют химические свойства металлов. Именно они участвуют в химических реакциях, образуя связи с другими атомами и ионами. Количество и расположение внешних электронов определяет реакционную способность металлов и их способность образовывать ионы.
Какова роль внешних электронов в электропроводности металлов?
Внешние электроны отвечают за электропроводность металлов. В металлической решетке внешние электроны свободно двигаются, благодаря чему металлы обладают высокой проводимостью электрического тока. Это объясняется наличием у металлов "моря" свободных электронов, которые не принадлежат ни к одному конкретному атому, а свободно перемещаются по металлической решетке.
