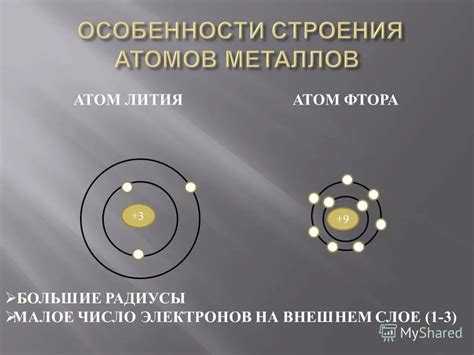
Металлы являются одной из основных категорий химических элементов. Отличительной особенностью металлов является их строение атомов. Атомы металлов обладают специфическими свойствами, позволяющими им выделяться на фоне других элементов.
Одной из основных особенностей атомов металлов является наличие свободных электронов в их внешней оболочке. Это позволяет металлам образовывать электронные облака, которые отвечают за их основные свойства, такие как высокая электропроводность и теплопроводность. Благодаря наличию свободных электронов, атомы металлов способны эффективно передавать энергию и электроны друг другу, а также взаимодействовать с другими веществами.
Строение атомов металлических элементов также определяет их способность образовывать кристаллические решетки. Металлическая решетка состоит из регулярно расположенных атомов, связанных между собой свободными электронами. Она придает металлам их специфическую структуру и позволяет им обладать высокой прочностью и упругостью.
Особенности строения атомов металлических элементов связаны с их электронной конфигурацией и расположением в периодической системе. Это определяет их химические и физические свойства, такие как плавление, кипение, тугоплавкость и магнитные свойства. Изучение строения атомов металлов является важным аспектом химии и материаловедения, позволяющим лучше понять их поведение и применение в различных отраслях науки и техники.
Что такое металлы и их строение?

Металлы – это особый класс элементов химического состава, которые обладают рядом уникальных свойств. Они обладают высокой тепло- и электропроводностью, отличаются высокой пластичностью и прочностью, способны отражать свет, а также обладают характерной металлической блеской.
Строение атомов металлических элементов имеет свои особенности. Как правило, атомы металлов обладают небольшим количеством валентных электронов в своей внешней электронной оболочке. В результате такого строения, металлы способны образовывать кристаллическую решетку, в которой положительно заряженные атомы металла образуют металлическую сетку и облако свободных электронов заполняет промежутки между атомами.
Структура металлов имеет ряд важных свойств:
- Высокая пластичность и прочность. Кристаллическая решетка позволяет атомам металла перемещаться относительно друг друга без разрушения связей.
- Высокая тепло- и электропроводность. Свободные электроны в металлической структуре позволяют быстро и эффективно передавать энергию и электрический ток.
- Отражение света. Свободные электроны обратно отражают световые волны, что придает металлам характерный блеск.
Перечисленные свойства структуры металлов делают их незаменимыми во многих отраслях промышленности, а также представляют научный интерес для изучения.
Металлы: классификация и основные свойства

Металлы - это группа химических элементов, которые обладают определенными физическими и химическими свойствами. Они являются одними из основных строительных блоков материального мира и широко используются в различных отраслях промышленности.
Классификация металлов осуществляется по различным признакам. В основе деления лежит их химическая природа и способность образовывать водорастворимые или влагостойкие соединения. Металлы можно разделить на легкие и тяжелые, благородные и базовые, черные и цветные. В зависимости от строения атомов металлов, они могут быть кубическими или гексагональными.
Основное свойство металлов - хорошая электропроводность. Это связано с особенностями строения и расположения электронов в их атомах. Кроме того, металлы обладают высокой теплопроводностью, легко поддаются обработке и формированию, обладают высокой пластичностью и прочностью. Они способны отражать свет, образуя блестящую поверхность - это их отличительная особенность.
Металлы широко применяются в промышленности и строительстве благодаря своей прочности и долговечности. Они используются для изготовления различных конструкций, машин и оборудования. Металлы также находят применение в электротехнике, автомобильной и авиационной промышленности, а также в производстве упаковочных материалов и различных изделий повседневного быта.
Примерами металлов являются железо, алюминий, медь, золото, серебро и многие другие элементы. Каждый металл имеет свои особенности и специфические свойства, которые определяют его применение в различных отраслях промышленности и строительства.
Строение атомов металлов: ядро и оболочки
Металлы – это группа химических элементов, характеризующихся высокой электропроводностью, блеском, плавкостью и возможностью образовывать ионные связи. Одной из особенностей металлов является их атомное строение, которое представляет собой сложную систему ядра и оболочек.
Ядро атома металла состоит из протонов и нейтронов. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Ядро обладает высокой плотностью и является центральным элементом атома. Основным свойством ядра является его масса, которая определяет массовое число атома.
Вокруг ядра располагаются электроны, которые образуют оболочки или электронные облака. Оболочки состоят из электронных слоев, расположенных на разных энергетических уровнях. Каждая оболочка может содержать определенное количество электронов. Находящиеся ближе к ядру электроны, называемые внутренними, обладают меньшей энергией, а электроны на внешних энергетических уровнях – внешними.
Строение атомов металлов имеет свои особенности. Оболочки металлов, как правило, имеют небольшое число электронов в внешних слоях, что делает их более склонными к образованию ионов с положительным зарядом. Это обуславливает возможность металлов образовывать ионные связи и обмен электронами с другими атомами. Также строение атомов металлов определяет их высокую электропроводность, так как свободные электроны могут передвигаться по материалу и обеспечивать электрическую проводимость.
Итак, строение атомов металлов включает ядро, состоящее из протонов и нейтронов, а также электронные облака, представленные оболочками из электронных слоев. Это строение обусловливает особенности металлов, такие как их высокая электропроводность и способность образовывать ионные связи.
Особенности электронного строения металлических элементов

Электронное строение металлических элементов обладает рядом интересных особенностей, которые определяют их уникальные свойства. Внешний энергетический уровень в атомах металлов отличается от уровня в атомах неметаллов, что приводит к формированию устойчивого металлического связующего вещества.
Главной особенностью электронного строения металлов является наличие так называемых свободных электронов. Причина их образования заключается в том, что электроны на самом высоком энергетическом уровне металла слабо привязаны к ядру и могут свободно перемещаться по всей его поверхности.
Такие свободные электроны обеспечивают металлам ряд уникальных свойств. Они способствуют высокой электропроводности и теплопроводности металлов, а также обуславливают их способность к формированию блестящей поверхности и эластической деформации.
Кроме того, электронное строение металлов определяет их способность образовывать ионы с положительным зарядом. Это связано с тем, что металлы имеют относительно низкую энергию ионизации, что позволяет им легко отдавать свои внутренние электроны и образовывать положительно заряженные ионы.
Металлическая связь: принципы и характеристики

Металлическая связь – это тип химической связи, в которой положительно заряженные ионы металла окружены облаком свободно движущихся электронов. Основной принцип металлической связи заключается в обмене электронами между ионами металла и свободными электронами. Это позволяет образовывать трехмерные структуры, называемые кристаллической решеткой, и дает металлам такие характеристики, как прочность, эластичность и электропроводность.
Главной особенностью металлической связи является наличие свободных электронов, которые могут свободно перемещаться по металлической решетке. Это обеспечивает металлам высокую электропроводность, так как электроны могут передаваться от атома к атому без сопротивления. Благодаря этому свойству металлы используются в производстве электроники, проводов и различных электрических приборов.
Кроме того, металлическая связь обеспечивает металлам высокую теплопроводность. Это связано с тем, что свободные электроны могут эффективно передавать тепловую энергию от атома к атому. Благодаря этому свойству металлы используются в производстве кухонной посуды, теплопроводящих материалов и систем охлаждения.
Металлическая связь также обладает высокой прочностью и эластичностью. Ионы металла в металлической решетке подвергаются взаимодействию со множеством соседних ионов, что обеспечивает силу связи между атомами металла. Благодаря этой силе металлы могут выдерживать большие нагрузки без деформации и разрушения. Именно поэтому они используются для создания конструкций, машин и автомобилей.
В целом, металлическая связь является одной из основных характеристик металлов и обуславливает их уникальные свойства. Она обеспечивает электропроводность, теплопроводность, прочность и эластичность металлов, делая их важным материалом в различных сферах промышленности и научных исследований.
Металлические свойства: проводимость, пластичность и теплопроводность

Металлы обладают рядом характерных свойств, которые делают их особенными. Одно из таких свойств – проводимость электричества. Проводимость металлов основывается на особой структуре их атомов. В металлах электроны, связанные с атомами, могут свободно перемещаться в металлической решетке, образуя так называемый «море» свободных электронов. Благодаря этому, металлы эффективно проводят электрический ток, будучи хорошими проводниками.
Пластичность – еще одно важное металлическое свойство. Она определяется способностью металлов изменять свою форму без разрушения и утраты своих свойств. Благодаря особому строению атомной решетки, в металлах отсутствуют регулярные порядки, что делает их способными к деформации. Металлы могут быть разрезаны, вытянуты и даже прокатаны в листы, не теряя своих характеристик.
Теплопроводность – еще одно замечательное свойство металлов. Это значит, что металлы хорошо проводят тепло. Внутри металлической решетки есть свободные электроны, которые могут передавать энергию от одного атома к другому. Благодаря этому, металлы могут равномерно распределять и передавать тепло, что делает их идеальными материалами для теплопроводных систем и устройств.
Особенности кристаллической структуры металлов
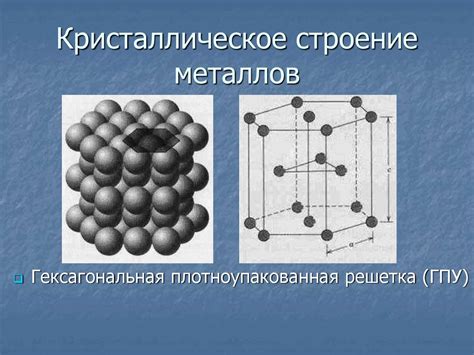
Кристаллическая структура металлов отличается особыми свойствами, которые обусловлены специфическими особенностями атомного строения. Одной из основных особенностей является формирование кристаллической решетки, которая обладает высокой степенью упорядоченности.
Металлы образуют кристаллическую структуру, в которой атомы упорядочены в регулярные трехмерные решетки. Атомы металла соединены между собой координационными связями, которые создают межатомное расстояние и обеспечивают прочность и устойчивость металлической структуры.
Кристаллическая структура металлов позволяет им обладать такими свойствами, как высокая прочность, пластичность и проводимость электричества и тепла. Атомы металла образуют регулярные плоскости, которые могут смещаться относительно друг друга без нарушения общей структуры, что позволяет металлам обладать пластичностью и способностью к деформации без разрушения.
Кристаллическая структура металлов также определяет их способность к проводимости электричества и тепла. В металлической решетке свободными электронами образуется электронное облако, которое может свободно перемещаться по всему объему металла. Это объясняет высокую электропроводность металлов и их способность к передаче тепла.
Таким образом, кристаллическая структура металлов определяет их уникальные свойства, которые делают их неотъемлемой частью многих современных технологий и применений.
Металлы в химических реакциях: окисление, коррозия и сплавление

Металлы являются важной группой элементов, которые активно участвуют в различных химических реакциях. Одним из наиболее распространенных процессов является окисление металлов. Окисление — это реакция, при которой металл взаимодействует с кислородом из воздуха или другими оксидантами. В результате окисления образуются оксиды металлов, которые могут иметь различные свойства и использоваться в разных областях.
Коррозия – это процесс разрушения металла вследствие его взаимодействия с окружающей средой, особенно с влажностью и агрессивными химическими веществами. Металлические изделия могут подвергаться коррозии и постепенно терять свои свойства и структуру. Для защиты от коррозии могут использоваться специальные покрытия, а также методы электролиза или гальванического покрытия металлом более низкой электрохимической активности.
Сплавление – это процесс смешивания двух или более металлов для создания нового материала с улучшенными свойствами. Сплавы обладают различными свойствами, такими как повышенная прочность, твердость, устойчивость к коррозии, проводимость электричества и тепла. Примерами сплавов являются бронза, латунь, сталь и алюминиевые сплавы. Сплавы могут использоваться в разных отраслях промышленности, включая авиацию, судостроение, электротехнику и другие.
Вопрос-ответ

Каковы особенности и свойства атомов металлических элементов?
Атомы металлических элементов имеют специфическую структуру, которая обусловливает их особые свойства. Одной из главных особенностей является наличие металлической связи, которая обеспечивается свободными электронами при отсутствии жестких связей между атомами. Благодаря этому, металлы обладают высокой электропроводностью, теплопроводностью и пластичностью. В атомах металлических элементов электроны находятся в общих энергетических оболочках, что позволяет им образовывать кристаллическую решетку и демонстрировать металлический блеск.
Какие свойства металлов связаны с их атомной структурой?
Атомная структура металлов обуславливает такие их свойства, как высокая теплопроводность и электропроводность. Это связано с наличием свободных электронов в атомах металлов, которые могут легко передаваться от одного атома к другому и обеспечивать проводимость тепла и электричества. Также атомная структура металлов обеспечивает их пластичность и деформируемость, что позволяет легко формировать металлические изделия и проводить обработку металлов методами литья, прокатки и т.д.
Почему металлы обладают хорошей электропроводностью? Какая связь между атомами металла отвечает за эту свойство?
Металлы обладают хорошей электропроводностью благодаря наличию свободных электронов в атомах металла. Эти электроны могут легко передвигаться от одного атома к другому и обуславливают проводимость электричества в металле. Это связано с особенностями металлической связи, которая образуется благодаря слабому взаимодействию между положительно заряженными ядрами атомов и отрицательно заряженными свободными электронами.
