Металлы являются одной из основных групп химических элементов, обладающих рядом выдающихся свойств. Во многом это обусловлено их структурой и электронной конфигурацией. Реакции металлов в химии имеют важное значение, так как они сопровождаются разнообразными химическими превращениями и позволяют не только изучить свойства металлов, но и применить их в ряде практических областей.
Одной из основных особенностей реакций металлов является их способность образовывать ионы положительного заряда. Это связано с тем, что металлы отдают электроны при взаимодействии с другими веществами. Такие реакции называются окислительно-восстановительными или просто окислительными реакциями. Они происходят в результате перехода электронов от металла к другим веществам, что приводит к образованию положительно заряженных ионов металла.
Важно отметить, что активность металлов в окислительных реакциях зависит от их положения в электрохимическом ряду. Так, металлы с более высокой электрохимической активностью (например, натрий или калий) имеют большую склонность отдавать электроны, а металлы с более низкой активностью (например, золото или серебро) проявляют меньшую способность к окислению.
Металлы также могут реагировать с различными кислотами, образуя соли и выделяя водород. Реакции металлов с кислотами называются ацидные реакции и часто сопровождаются выделением пузырьков газа и появлением шипения. При этом металл активно вступает во взаимодействие с кислотой, отдавая свои электроны и образуя соответствующие ионы.
Таким образом, реакции металлов отражают их химические свойства и позволяют узнать больше о их активности и способности взаимодействовать с другими веществами. Изучение данных реакций имеет значительное практическое применение, включая использование металлов в различных отраслях промышленности и создание новых материалов с уникальными свойствами.
Физические свойства металлов
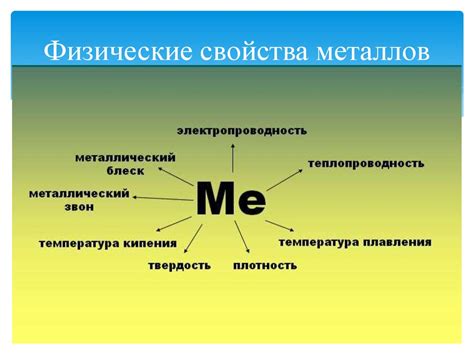
Плотность – одно из основных физических свойств металлов. Они отличаются высокой плотностью, что означает, что их масса на единицу объема является большой. Например, плотность железа составляет около 7,8 г/см³, а плотность свинца – около 11,3 г/см³.
Теплопроводность – еще одно важное свойство металлов. Они обладают высокой способностью проводить тепло. Благодаря этому свойству, металлы применяются в изготовлении кухонной посуды, радиаторов и других предметов, где требуется эффективный теплообмен.
Электропроводность – характерное свойство металлов, позволяющее им эффективно проводить электрический ток. Металлы широко используются в электротехнике и электронике для создания проводников, контактов и других деталей электрических цепей.
Плавление и кипение – для многих металлов характерна высокая температура плавления и кипения. Например, температура плавления алюминия составляет около 660°C, а кипения – около 2510°C. Такие свойства позволяют использовать металлы для создания конструкций, которые будут работать при высоких температурах.
Механическая прочность – металлы обладают высокой механической прочностью, что делает их незаменимыми материалами для создания конструкций и деталей, выдерживающих большие нагрузки. Прочность металлов объясняется их кристаллической структурой и возможностью образования связей между атомами.
Пластичность и ударная вязкость – металлы способны выдерживать пластическую деформацию, сохраняя при этом свою прочность и форму. Благодаря этому свойству, металлы могут быть легко обрабатываться и дать нужную форму, например, при ковке или литье. Ударная вязкость металлов определяет их способность выдерживать ударную нагрузку без разрушения.
Отражательная способность – многие металлы обладают высокой способностью отражать свет. Благодаря этому свойству, металлы часто используются при изготовлении зеркал, пленок, а также в электро-оптических устройствах.
Таким образом, металлы обладают рядом характерных физических свойств, таких как высокая плотность, теплопроводность, электропроводность, высокая температура плавления и кипения, механическая прочность, пластичность и ударная вязкость, а также отражательная способность. Эти свойства определяют широкое применение металлов в различных отраслях промышленности и техники.
Металлы в химических реакциях

Металлы – это класс химических элементов, которые обладают высокой теплопроводностью, электропроводностью и блеском. Они образуют большую часть периодической системы элементов и играют важную роль во многих химических реакциях.
Одной из основных характеристик металлов является их способность к окислению и восстановлению. Металлы образуют соединения с другими элементами путем обмена электронами, что позволяет им участвовать в различных химических реакциях и образовать сложные соединения.
В химических реакциях металлы могут проявлять свои особенности. Например, они способны к взаимодействию с кислородом, образуя оксиды. Это связано с тем, что металлы имеют слабую силу поверхностного слоя и легко отделяют свои электроны, что способствует образованию реакций окисления.
Также металлы могут реагировать с кислотами и образовывать соли. Например, реакция меди с соляной кислотой приводит к образованию солей меди и выделению водорода. Это обусловлено способностью металлов отдавать свои электроны и вступать в активные химические реакции с другими веществами.
Стоит отметить, что не все металлы одинаково активны в химических реакциях. Некоторые металлы, такие как золото и платина, практически не вступают в реакции с другими веществами. В то же время, некоторые металлы, такие как натрий и калий, являются очень реактивными и образуют соединения с большинством химических элементов.
Кислотные реакции металлов
Одной из наиболее широко изученных и важных химических реакций металлов являются их реакции с кислотами. Как известно, металлы реагируют с кислотами, образуя соли и выделяя водород. Эта реакция происходит за счет перехода электронов от металла на ионы водорода.
Кислотные реакции металлов можно представить в виде обобщенного уравнения:
Металл + Кислота → Соль + Водород
Например, реакция железа с соляной кислотой выглядит следующим образом:
| Металл | Кислота | Соль | Водород |
|---|---|---|---|
| Fe | HCl | FeCl2 | H2 |
В зависимости от активности металла и концентрации кислоты, скорость и интенсивность реакции может различаться. Наиболее активные металлы, такие как натрий и калий, реагируют с кислотами очень быстро и интенсивно, часто с выделением огня или пламени.
Кислотные реакции металлов являются одним из основных методов получения солей. Этот процесс широко используется в промышленности и лабораторной практике для синтеза различных соединений и материалов.
Кроме того, кислотные реакции металлов имеют большое практическое применение в повседневной жизни. Например, многие бытовые товары, такие как батарейки, основаны на реакции металлов с кислотами, которая обеспечивает постоянную подачу электрического тока.
Окислительно-восстановительные реакции металлов

Окислительно-восстановительные реакции являются одной из основных характеристик химических свойств металлов. Металлы могут вступать в реакции окисления и восстановления, при которых происходит передача электронов. В реакции окисления металл отдает электроны, превращаясь в положительный ион – катион, а в реакции восстановления металл принимает электроны, превращаясь в нейтральный состав или отрицательный ион – анион.
Окислительно-восстановительные реакции металлов особенно заметны при их взаимодействии с кислородом. Металлы активной группы, такие как натрий, калий, литий и другие, с легкостью реагируют с кислородом из воздуха, окисляясь при этом. Например, натрий при нагревании с горением сформирует оксид натрия: 4Na + O2 → 2Na2O. Такие реакции широко используются для получения оксидов металлов.
Металлы могут также реагировать с кислотами, проявляя окислительные свойства. Это особенно ярко проявляется у таких металлов, как железо и цинк. Например, взаимодействие железа с соляной кислотой приводит к образованию соли и выделению водорода: Fe + 2HCl → FeCl2 + H2. Такие реакции используются для получения газа водорода и соответствующих солей металлов.
Взаимодействие металлов с неметаллами

Взаимодействие металлов с неметаллами является важной химической реакцией, которая происходит при соприкосновении различных элементов. Эти реакции могут быть как пораждающими, так и благоприятными, и определяют химические свойства и возможности элементов.
Одной из наиболее распространенных реакций является окисление металлов при взаимодействии с кислородом. В результате образуется металлический окисел, который часто имеет форму покрытия на поверхности металла. Этот процесс называется коррозией и может приводить к разрушению металлических конструкций.
Также металлы могут взаимодействовать с другими неметаллами, такими как сера, фосфор или галогены. При этом образуются соединения, которые могут иметь различные свойства. Например, соединение металла с серой может образовать сульфид, который является твердым веществом с характерными запахом и цветом.
Взаимодействие металлов с неметаллами также может происходить в растворах или при высоких температурах. Например, некоторые металлы могут реагировать с кислотами, образуя соли и высвобождая водород. Этот процесс называется реакцией с кислотой и широко используется в промышленности.
Таким образом, взаимодействие металлов с неметаллами является важной частью химической реакции, определяющей свойства и возможности элементов. Эти реакции могут быть разнообразными и играть значительную роль как в естественных процессах, так и в промышленных технологиях.
Реакции металлов с водой

Металлы очень активно взаимодействуют с водой, образуя оксиды металлов и выделяя водород. Реакция металлов с водой происходит различными способами в зависимости от их химических свойств и степени активности.
Наиболее активные металлы, такие как калий и натрий, сильно реагируют с водой, выделяя большое количество водорода и образуя щелочи. Реакция этих металлов с водой является самовозгораемой и сопровождается выпуском пламени и хрустящим звуком.
Более умеренно активные металлы, такие как магний и цинк, реагируют с водой медленно, но все же выделяют водород. Реакция этих металлов с водой протекает при нагревании или в присутствии катализаторов.
Некоторые металлы, например, железо и алюминий, образуют при реакции с водой их оксиды и гидроксиды, но не выделяют значительное количество водорода. Их реакция с водой происходит медленно, с образованием тонкой пленки оксида на поверхности металла, которая препятствует дальнейшему контакту с водой.
Есть также металлы, например, серебро и платина, которые не реагируют с водой при обычных условиях, так как обладают низкой активностью. Однако, они могут реагировать с водой при высоких температурах и/или в присутствии катализаторов.
В таблице ниже приведены некоторые металлы и их реакция с водой:
| Металл | Реакция с водой |
|---|---|
| Калий | Самовозгорание, образование щелочи |
| Натрий | Самовозгорание, образование щелочи |
| Магний | Выделение водорода |
| Цинк | Выделение водорода |
| Железо | Образование гидроксида |
| Алюминий | Образование оксида и гидроксида |
| Серебро | Не реагирует при обычных условиях |
| Платина | Не реагирует при обычных условиях |
Таким образом, реакция металлов с водой может как проявляться яркими огненными вспышками и шипением, так и протекать без видимых признаков. Физические и химические свойства каждого металла определяют его способность взаимодействовать с водой и выпускать водород.
Металлы в органической химии
Металлы играют важную роль в органической химии, так как они могут служить катализаторами для реакций, участвовать в образовании соединений и обладать уникальными химическими свойствами.
Катализаторы на основе металлов часто применяются в органическом синтезе для ускорения химических реакций. Например, палладий и платина часто используются в реакциях гидрогенирования, а никель и железо - в реакциях сведения. Катализаторы на основе металлов способствуют повышению скорости реакций и эффективности процессов синтеза.
Металлы также могут образовывать соединения с органическими молекулами. Например, органические кислоты могут образовывать соли с металлами, такими как натрий или калий. Это позволяет использовать металлы в органическом синтезе для получения новых соединений и улучшения свойств органических молекул.
Металлы также могут проявлять уникальные химические свойства в органической химии. Например, некоторые металлы, такие как медь и железо, могут участвовать в реакциях окисления-восстановления и обладать антиоксидантными свойствами. Это позволяет использовать металлы в органической химии для защиты от окисления и стабилизации органических соединений.
Таким образом, металлы играют важную роль в органической химии, обладая свойствами катализаторов, образовывая соединения с органическими молекулами и проявляя уникальные химические свойства. Использование металлов в органическом синтезе способствует развитию новых методов и процессов, что приводит к получению новых соединений с улучшенными свойствами.
Вопрос-ответ

Какие физические свойства обладают металлы?
Металлы обладают такими физическими свойствами как высокая теплопроводность, электропроводность, металлический блеск, пластичность и широкий диапазон плавления и кипения.
Какие металлы становятся активными при реакции с кислородом?
Активными при реакции с кислородом становятся алкалии, алкалиноземельные металлы и некоторые металлы-переходники, такие как железо, никель и медь.
Почему металлы проявляют способность к окислению?
Металлы обладают способностью к окислению тем, что они имеют низкую электроотрицательность и легко отдают электроны. При контакте с окислителем, металлы отдают электроны, образуя положительно заряженные ионы и сами становятся отрицательно заряженными.
Какие металлы реагируют с кислотами?
Сильные кислоты, такие как соляная кислота или серная кислота, реагируют с рядом металлов, включая магний, цинк и железо. Реакция таких металлов с кислотами приводит к выделению водорода и образованию соответствующих солей.
Что такое гальваническая коррозия?
Гальваническая коррозия - это процесс, при котором металл, находящийся в контакте с другим металлом в электролите, подвергается разрушению из-за химических реакций, происходящих при электрическом контакте. Это происходит из-за разности электрохимического потенциала металлов, что приводит к образованию гальванической пары и активной коррозии одного из металлов.
