Металлы — это вещества, обладающие специфическими физическими и химическими свойствами. Одним из важных аспектов изучения металлов является их электронное строение атомов, которое играет решающую роль в их поведении и свойствах.
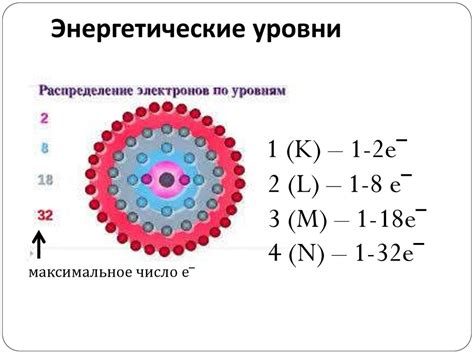
Атомы металлов обладают особенностями в распределении электронов по энергетическим уровням. Обычно большинство металлов имеет много электронов, расположенных на внешнем энергетическом уровне. Этот факт делает металлы хорошими проводниками электричества и тепла.
Электроны, находящиеся в свободном состоянии внешнего энергетического уровня металлов, могут свободно двигаться внутри материала, что позволяет металлам проявлять свое основное свойство — хорошую электропроводность. Кроме того, электроны металлов с легкостью мигрируют под воздействием электрического поля, что обеспечивает электрическую связь между атомами и, в конечном счете, обуславливает металлические свойства вещества.
Металлы: строение атомов и электронная конфигурация
Металлы – это класс веществ, отличающихся высокой электропроводностью и пластичностью. Особенностью электронного строения атомов металлов является наличие свободных электронов в их внешней оболочке.
Основу металлической связи составляют сильные взаимодействия между положительно заряженными ядрами атомов и свободными электронами. В результате таких взаимодействий, свободные электроны могут передвигаться по всему объему металла, образуя так называемое "море электронов".
Строение атома металла характеризуется наличием относительно большого количества электронов в внешней электронной оболочке. Эти электроны называются валентными. Они обладают свободой передвижения, что объясняет электропроводность металлов.
Электронная конфигурация атома металла определяет его химические свойства. Например, элементы с полностью заполненной d-оболочкой, такие как железо или медь, обладают хорошей проводимостью электричества и тепла, а также высокой прочностью и устойчивостью к окислению.
Таким образом, электронное строение атомов металлов, с их наличием свободных электронов в валентной оболочке, определяет их физические и химические свойства, а также отличает металлы от других классов веществ.
Металлы: особенности атомов

Металлы – это химический элемент или сплав, обладающий отличной от полупроводников и неметаллов проводимостью электричества. Одной из особенностей атомов металлов является наличие свободных электронов во внешней оболочке.
Обычно у атомов металлов электронные оболочки имеют небольшое количество электронов, что делает их малоустойчивыми и склонными к образованию свободных электронов. Это явление называется деформацией электронной оболочки. Благодаря этому свойству, металлы обладают высокой электропроводностью и теплопроводностью.
Свободные электроны в металлах образуют так называемое «море свободных электронов». Эта электронная структура позволяет электронам двигаться свободно в кристаллической решетке металла. Под влиянием электрического поля свободные электроны начинают двигаться в одном направлении, что обеспечивает электропроводность металла.
В заключение, свободные электроны являются основной причиной особых электрофизических свойств металлов. Это делает их важными материалами для различных отраслей промышленности и технологии.
Строение атомов металлов
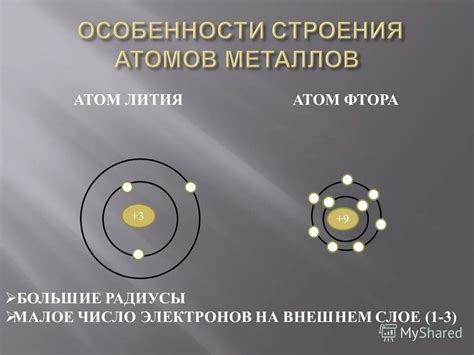
Атомы металлов отличаются от других типов атомов своим особенным электронным строением. Они обладают малым количеством валентных электронов, что делает их хорошими проводниками электричества и тепла.
У атомов металлов внешний энергетический уровень содержит всего несколько электронов, что обуславливает их свойства. Такие атомы стремятся потерять эти валентные электроны и приобрести стабильное электронное строение. Именно эта особенность является причиной их активности в химических реакциях.
Строение атомов металлов обуславливает их способность формировать металлическую связь, которая характеризуется перемещением свободных электронов между атомами. Именно благодаря этому свойству металлы обладают высокой электропроводностью и теплопроводностью.
Кроме того, у атомов металлов часто наблюдаются сдвоенные электронные оболочки, состоящие из внутренней и внешней оболочки. Это наблюдается в атомах металлов, которые находятся в долевом состоянии в молекуле или кристаллической решетке, и они обладают особенными свойствами, такими как ферромагнетизм.
Электронная конфигурация атомов металлов

Электронная конфигурация атома металла определяет распределение его электронов по энергетическим орбиталям. Изучение этой конфигурации позволяет лучше понять особенности строения атомов металлов и их химические свойства.
В основном, атомы металлов имеют от одного до трех электронов во внешней оболочке, которая называется валентной. Валентные электроны отвечают за химическую активность атома и его способность образовывать соединения. Поэтому наличие дополнительных валентных электронов часто делает металлы более реактивными и склонными к образованию соединений.
Например, одним из самых распространенных металлов является железо. Атом железа имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Здесь можно заметить, что у атома железа 2 валентных электрона. Это делает железо химически активным и способным образовывать многочисленные соединения.
Важным свойством металлов является их способность проводить тепло и электричество. Это связано с наличием свободных электронов в зоне проводимости. У металлов, чья электронная конфигурация содержит несколько электронов в зоне проводимости, есть высокая проводимость электричества и тепла.
В целом, электронная конфигурация атомов металлов определяет их химические свойства и способность образовывать соединения. Понимание этой конфигурации позволяет углубиться в изучение качеств и особенностей металлов, их применения и взаимодействия с другими веществами.
Роль электронной конфигурации в свойствах металлов

Электронная конфигурация атомов металлов играет ключевую роль в определении их свойств и характеристик. Структура электронных оболочек атомов влияет на проводимость тепла и электричества, металлический блеск, пластичность и тугоплавкость металлов.
В металле электроны валентной оболочки не прикреплены к отдельным атомам, а образуют так называемый "море электронов". Это означает, что электроны могут свободно двигаться по всей структуре металла, что обеспечивает высокую электропроводность и теплопроводность металлов.
Интересно, что электронная конфигурация также влияет на химическую активность металлов. Например, внешние электроны, находящиеся на валентной оболочке, могут легко участвовать в химических реакциях, что делает металлы хорошими окислителями. Это объясняет их способность образовывать положительные ионы, например, при образовании солей.
Изменение электронной конфигурации может также влиять на физические свойства металлов. Например, добавление примесей к металлу может изменить его проводимость или магнитные свойства. Изменение электронной конфигурации путем аллотропии также может привести к изменению структуры металлического материала и его механических свойств, таких как твердость или пластичность.
Вопрос-ответ

Какие особенности электронного строения атомов характерны для металлов?
Особенности электронного строения атомов металлов заключаются в том, что они имеют маленькую энергию ионизации и большую проводимость электричества и тепла. Это связано с наличием свободных электронов в энергетической зоне проводимости, которые свободно двигаются между атомами металла.
Почему металлы обладают высокой проводимостью электричества и тепла?
У металлов высокая проводимость электричества и тепла связана с особенностями их электронного строения. В металлах в энергетической зоне проводимости находятся свободные электроны, которые легко двигаются под действием электрического поля. Это позволяет электронам свободно перемещаться по металлической решетке, перенося электрический ток. Также свободные электроны отлично проводят тепло, что делает металлы хорошими теплопроводниками.
