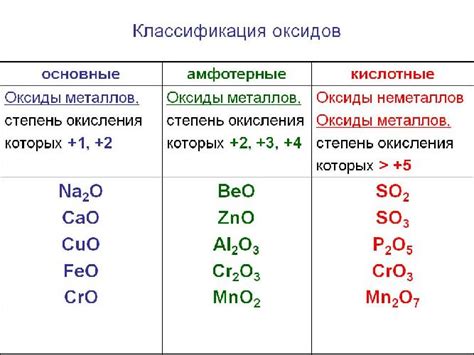
Оксиды металлов – это химические соединения, состоящие из атомов металла и кислорода. Они обладают широким спектром свойств и играют важную роль в химических реакциях и промышленных процессах.
Оксиды металлов могут быть разделены на две основные группы: основные и амфотерные оксиды. Основные оксиды обладают щелочными свойствами и реагируют с кислотами, образуя соли и воду. Амфотерные оксиды, в свою очередь, могут проявлять как щелочные, так и кислотные свойства в зависимости от условий реакции.
Свойства оксидов металлов определяются их структурой и электрохимическими характеристиками. Оксиды металлов обычно обладают высокой твердостью, тугоплавкостью и являются некоторыми из самых распространенных минералов на Земле. Они также могут иметь специфическую цветность, что делает их ценными в ювелирной и керамической промышленности.
Амфотерные оксиды, в отличие от основных оксидов, имеют способность реагировать как с кислотами, так и с щелочами. Это свойство обусловлено наличием свободных электронных пар на поверхности оксида металла, что позволяет ему взаимодействовать с различными химическими веществами. Амфотерные оксиды металлов находят применение в производстве катализаторов, электролитов и других материалов с уникальными свойствами.
Основные оксиды металлов
Основные оксиды металлов являются соединениями, которые образуются при взаимодействии металлов с кислородом. Они обладают щелочными свойствами и растворяются в воде, образуя щелочные растворы.
У основных оксидов металлов различные физические и химические свойства. Некоторые основные оксиды обладают высокой степенью растворимости в воде, в то время как другие образуют нерастворимые осадки.
- Нерастворимые основные оксиды: к ним относятся, например, оксиды свинца, железа и меди. Они способны образовывать осадки при взаимодействии с кислотами и другими реагентами.
- Растворимые основные оксиды: это оксиды щелочных металлов, таких как оксид натрия и оксид калия. Они полностью растворяются в воде, образуя щелочные растворы.
Основные оксиды металлов реагируют с кислотами, образуя соли. Они также могут образовывать гидроксиды при реакции с водой.
| Металл | Оксид | Гидроксид |
|---|---|---|
| Натрий | Na2O | NaOH |
| Калий | K2O | KOH |
| Железо | Fe2O3 | Fe(OH)3 |
Основные оксиды металлов широко применяются в промышленности, в производстве минеральных удобрений, стекла и керамики. Они также играют важную роль в химической и электронной промышленности.
Свойства основных оксидов металлов

Основные оксиды металлов - это соединения металлов с кислородом. Они обладают рядом свойств, характерных для основных соединений.
1. Щелочная реакция: основные оксиды металлов обладают выраженной щелочной реакцией с водой, что проявляется в образовании щелочных растворов. При растворении основного оксида в воде происходит образование гидроксида этого металла.
2. Образование солей: основные оксиды металлов реагируют с кислотами, образуя соли. Реакция протекает с выделением большого количества тепла и образованием воды.
3. Электролитическая диссоциация: основные оксиды металлов в растворе образуют ионы металла и гидроксид-ионы. Это свойство позволяет им проявлять химическую активность и участвовать в реакциях обмена.
4. Окислительные свойства: многие основные оксиды металлов обладают окислительными свойствами. Они способны отдавать кислородные атомы и получать металлическое состояние. Это свойство проявляется при взаимодействии основных оксидов с веществами, которые могут быть окислены.
5. Другие свойства: основные оксиды металлов обычно обладают высокой температурой плавления и кипения. Они образуют кристаллические структуры, имеют хорошую проводимость тепла и электричества, а также могут образовывать соединения с другими элементами.
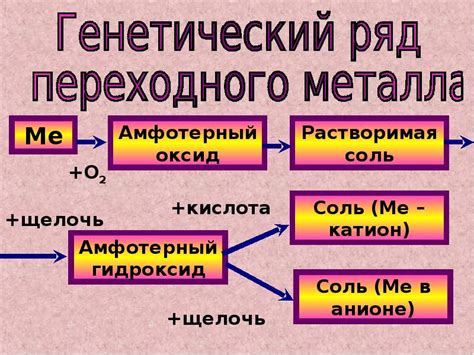
Амфотерные оксиды металлов

Амфотерными оксидами называются соединения металлов, которые могут проявлять кислотные и щелочные свойства в зависимости от условий реакции. Они обладают способностью образовывать соляры - соли, образующиеся при действии кислоты и щелочи на амфотерный оксид.
Примером амфотерного оксида является оксид алюминия (Al2O3). В реакции с кислотами он проявляет свойства оснований, образуя алюминаты. С другой стороны, оксид алюминия может реагировать с щелочами, проявляя кислотные свойства, и образовывать алюминаты щелочных металлов.
Также к амфотерным оксидам относится оксид цинка (ZnO). В контакте с кислотами он действует как основание, образуя цинкаты. Взаимодействуя с щелочами, оксид цинка выступает в роли кислоты и образует цинкаты щелочных металлов.
Амфотерные оксиды обладают важными свойствами, которые позволяют им использоваться в различных областях. Например, оксид алюминия применяется в производстве керамики, стекол и алюминиевых сплавов, а оксид цинка используется в производстве красок, лаков и солнцезащитных средств.
Свойства амфотерных оксидов металлов
Амфотерные оксиды металлов представляют собой вещества, которые могут проявлять свойства как оснований, так и кислот. Это связано с их способностью реагировать с кислотами и щелочами.
Амфотерные оксиды проявляют амфотерность в результате присутствия в их структуре различных типов химических связей. Одни из этих связей позволяют оксидам образовывать кислоты или основания, а другие позволяют им проявлять кислотные или щелочные свойства взаимодействуя соответственно с основаниями или кислотами.
Свойства амфотерных оксидов можно проиллюстрировать следующими примерами. Оксид алюминия (Al2O3) образует сильные основания, реагируя с кислотами, например, соляной кислотой. Он также образует слабые кислоты в реакции с щелочами, например, гидроксидом натрия. Подобные свойства имеет также оксид цинка (ZnO), который реагирует с кислотами и основаниями.
Свойства амфотерных оксидов металлов представляют их важность при производстве различных материалов. Они широко используются в качестве катализаторов, полупроводников, керамики и красителей. Их способность реагировать с различными веществами и принимать участие в различных процессах делает их незаменимыми в различных областях промышленности.
Реакции основных оксидов металлов с водой

Основные оксиды металлов – это оксиды, которые способны взаимодействовать с водой и образовывать основания. Такие реакции часто бывают экзотермическими, то есть сопровождаются выделением тепла. При этом образуются соответствующие гидроксиды металлов.
Реакция основных оксидов металлов с водой происходит в несколько этапов. Сначала между оксидом и водой происходит химическая реакция, в результате которой образуется гидроксид металла и выделяется тепло. Затем гидроксид, образовавшийся в результате этой реакции, диссоциирует на ионы и образует раствор, который становится щелочным.
Реактивность основных оксидов металлов с водой может быть различной. Некоторые металлы, например натрий и калий, реагируют с водой очень активно и даже могут выделяться пламенем. Другие металлы, такие как медь или серебро, реагируют с водой гораздо медленнее и не столь ярко. Реакция может протекать с различной интенсивностью в зависимости от концентрации гидроксида металла и других факторов.
Реакции основных оксидов металлов с водой имеют широкое применение в различных областях науки и промышленности. Например, такие реакции используются в процессе производства щелочей и различных химических соединений. Кроме того, эти реакции имеют большое значение в биологии и жизни организмов, поскольку гидроксиды металлов являются основными компонентами многих живых систем.
Применение оксидов металлов в промышленности

Оксиды металлов широко применяются в различных отраслях промышленности благодаря своим уникальным свойствам. Например, оксид железа (Fe2O3), или ржавчина, используется в производстве красок и пигментов для окрашивания материалов и создания декоративных покрытий. Благодаря своей стойкости к коррозии, оксид железа используется также в производстве металлических конструкций и изделий, подверженных агрессивному окружающему воздействию.
Оксиды металлов также имеют важное применение в катализе. Например, оксид алюминия (Al2O3) часто используется в качестве носителя катализаторов, так как обладает высокой поверхностной активностью и термической стабильностью. Оксиды металлов могут быть использованы для ускорения химических реакций, повышения эффективности процессов и обеспечения высокого качества продукции.
Еще одним примером применения оксидов металлов в промышленности является использование оксида цинка (ZnO) в производстве резиновых, пластмассовых и текстильных материалов. Оксид цинка обладает антимикробными свойствами и способствует усилению устойчивости материалов к механическим повреждениям, ультрафиолетовому излучению и высоким температурам.
Кроме того, оксиды металлов применяются в производстве стекла, керамики и катализаторов для очистки отходов промышленности. Например, оксид титана (TiO2) используется в производстве белой краски и стекловидного материала, так как обладает высокой оптической прозрачностью и отражающей способностью.
Таким образом, оксиды металлов играют ключевую роль в промышленности, обеспечивая высокую производительность, стойкость к коррозии и новые функциональные свойства материалов и продуктов.
Вопрос-ответ

Какие металлы могут быть основными оксидами?
Основные оксиды образуются большинством металлов, например, натрия (Na2O), калия (K2O), кальция (CaO), железа (Fe2O3) и так далее.
Что такое амфотерные оксиды и какие металлы могут их образовывать?
Амфотерные оксиды – это оксиды, которые могут проявлять и кислотные, и щелочные свойства в зависимости от условий. К таким металлам относятся алюминий (Al2O3), цинк (ZnO), свинец (PbO) и др.
Какие основные свойства имеют основные оксиды металлов?
Основные оксиды металлов взаимодействуют с водой, образуя щелочи. Они обладают щелочной реакцией, хорошо растворяются в воде и образуют гидроксиды металлов.
Каковы особенности амфотерных оксидов?
Амфотерные оксиды могут проявлять как кислотные, так и щелочные свойства, взаимодействуя с кислотами и базами. Они могут растворяться как в кислотных, так и в щелочных растворах. Также они могут образовывать соли как с кислотами, так и с щелочами.
