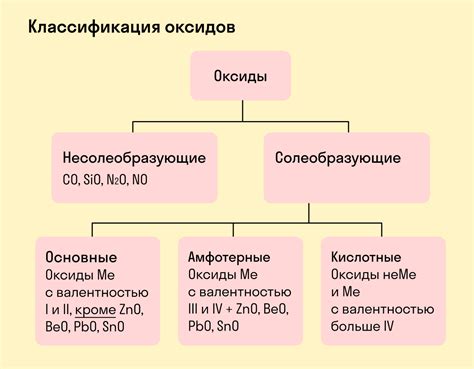
Металлы являются одним из основных классов химических элементов и широко используются в различных отраслях промышленности и научных исследованиях. Они обладают большим количеством полезных свойств, таких как электропроводность, термостойкость и прочность. Но являются ли металлы кислотообразующими элементами и образуют ли они кислотные оксиды?
Металлы обычно образуют основные оксиды, которые реагируют с водой и давая соответствующие основные растворы. Они имеют свойства щелочей, соответствующие ионы гидроксидов и могут нейтрализовать кислоты. Однако, существуют исключения, и некоторые металлы действительно могут образовывать кислотные оксиды.
Некоторые металлы, такие как оксиды металлов IV группы (таких как кремний и титан), образуют кислотные оксиды в высоких окислительных состояниях. Эти оксиды обладают кислотными свойствами и могут реагировать с водой, образуя кислотные растворы. Также стоит отметить, что реакция металлов с кислородом воздуха может приводить к образованию оксидов, которые могут иметь свойства как щелочных, так и кислотных оксидов, в зависимости от специфических условий реакции.
Металлы: кислотные ли оксиды образуют?
Металлы — это элементы преимущественно катионного характера, образующие положительно заряженные ионы в растворах. Одной из характеристик металлов является их способность образовывать оксиды.
Оксиды металлов могут образовываться как кислотные, так и основные соединения. Кислотные оксиды образуются при взаимодействии металлов с кислородом. В результате этой реакции образуется оксид, который в растворах может образовывать кислоты. Примеры таких оксидов включают оксиды серы, азота, фосфора.
Однако не все оксиды металлов являются кислотными. Некоторые металлы, например, щелочные и щелочноземельные металлы, образуют основные оксиды. Они реагируют с водой, образуя гидроксиды и выделяя щелочные растворы. Примерами основных оксидов являются оксиды натрия (Na2O) и кальция (CaO).
Таким образом, металлы могут образовывать как кислотные, так и основные оксиды, в зависимости от своей химической природы и условий реакции.
Что такое металлы?

Металлы - это химический класс элементов, обладающих специфическими физическими и химическими свойствами. Они характеризуются высокой проводимостью тепла и электричества, высокой пластичностью, твердостью и блеском, которые делают их полезными в различных областях науки и промышленности.
Металлы обычно образуют катионы (положительно заряженные ионы) при химических реакциях, такие катионы металлов полностью или частично теряют электроны при взаимодействии с другими элементами или соединениями. Это делает металлы отличными проводниками электричества и тепла.
Одной из важнейших характеристик металлов является их способность образовывать оксиды. Оксиды металлов представляют собой химические соединения, состоящие из металлического и кислородного атомов. Многие металлы могут образовывать как основные, так и кислотные оксиды, в зависимости от условий реакции.
Основные оксиды образуются при реакции металлов с кислородом и обладают щелочными свойствами. Кислотные оксиды в свою очередь образуются при взаимодействии металлических оксидов с кислотами и обладают кислотными свойствами.
Все металлы могут образовывать оксиды, но у каждого металла есть свои характеристики и свойства, которые могут варьироваться в зависимости от его положения в периодической системе элементов.
Окисление и оксиды

Окисление – это химическая реакция, при которой вещество теряет электроны. Оксидация является одной из основных реакций, которые могут происходить с металлами. Окисление происходит под влиянием кислорода и других окислителей.
Оксиды – это вещества, образующиеся в результате реакции металлов с кислородом или другими окислителями. Оксиды металлов могут быть как кислотными, так и щелочными. Кислотные оксиды образуются при реакции металлов с кислородом, а щелочные оксиды образуются при реакции металлов с щелочными окислителями, такими как гидроксиды щелочных металлов.
Кислотные оксиды имеют кислотные свойства и реагируют с водой, образуя кислоты. Например, кислотным оксидом является оксид серы, SO2. При реакции с водой он образует серную кислоту:
- SO2 + H2O → H2SO3
Щелочные оксиды имеют щелочные свойства и реагируют с водой, образуя гидроксиды щелочных металлов. Например, щелочным оксидом является оксид натрия, Na2O. При реакции с водой он образует гидроксид натрия:
- Na2O + H2O → 2NaOH
Оксиды играют важную роль в промышленности, медицине и других отраслях. Например, оксид цинка используется в качестве катализатора, а оксиды свинца используются для производства аккумуляторов. Также некоторые оксиды металлов, такие как оксид алюминия и оксид кремния, используются в строительстве для производства различных материалов.
Оксиды металлов
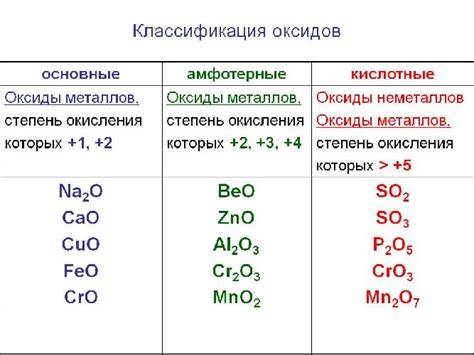
Оксиды металлов – это химические соединения, состоящие из кислорода и металла. Оксиды металлов являются одними из наиболее распространенных классов неорганических соединений. Они обладают различными физическими и химическими свойствами, что делает их важными веществами в различных промышленных процессах и технологиях.
Оксиды металлов могут образовываться как при сжигании металлов в кислороде, так и при окислении металлов воздухом или другими окислителями. Образование оксидов металлов является естественным процессом, который происходит при взаимодействии металлов с кислородом в атмосфере.
Количество кислорода в оксиде металла может варьироваться, что влияет на его химические свойства. Некоторые оксиды металлов являются кислотными и могут реагировать с водой, образуя кислоты. Другие оксиды металлов не обладают кислотными свойствами и считаются нейтральными.
Оксиды металлов играют важную роль в различных областях науки и техники. Их применяют в производстве металлургических материалов, катализаторов, электродов, керамики и других функциональных материалов. Некоторые оксиды металлов обладают полупроводниковыми свойствами и используются в производстве электронных компонентов.
- Оксид железа (Fe2O3) – используется для производства стали и неорганических красителей;
- Оксид алюминия (Al2O3) – широко применяется в качестве катализатора, абразивного материала и составной части керамических материалов;
- Оксид меди (CuO) – используется в электронном и электротехническом оборудовании;
- Оксид цинка (ZnO) – применяется в производстве резиновых изделий, красок и лаков;
- Оксид антимония (Sb2O3) – используется в производстве гидратов и пигментов.
Таким образом, оксиды металлов являются важными химическими соединениями, которые широко используются в промышленности и науке. Их свойства и применение зависят от состава и структуры оксида, что делает изучение этих соединений актуальной задачей для многих научных исследований.
Основные и амфотерные оксиды
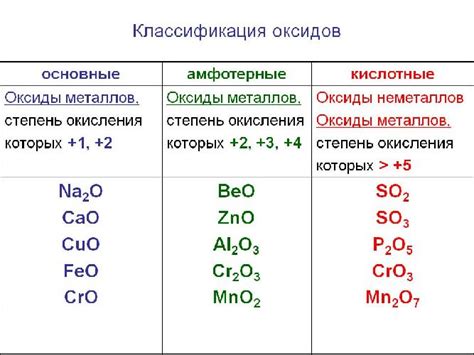
Основные оксиды - это оксиды металлов, которые образуются в результате соединения металла с кислородом. Они характеризуются способностью образовывать растворимые основания в реакции с водой. Основные оксиды имеют щелочную реакцию и способны нейтрализовать кислоты.
Примеры основных оксидов: оксид натрия (Na2O), оксид калия (K2O), оксид кальция (CaO). При реакции с водой они образуют соответствующие гидроксиды: Na2O + H2O = 2NaOH.
Амфотерные оксиды - это оксиды металлов, которые могут проявлять свойства и основного, и кислотного характера. Они способны реагировать как с кислотами, так и с основаниями.
Примеры амфотерных оксидов: оксид алюминия (Al2O3), оксид цинка (ZnO), оксид свинца (PbO). Они реагируют с кислотами, образуя соли, и с щелочами, образуя соответствующие гидроксиды.
Некоторые металлы могут образовывать и кислотные оксиды, которые реагируют с водой, образуя кислоты. Например, оксид серы (SO3) при реакции с водой образует серную кислоту (H2SO4).
Кислотные оксиды
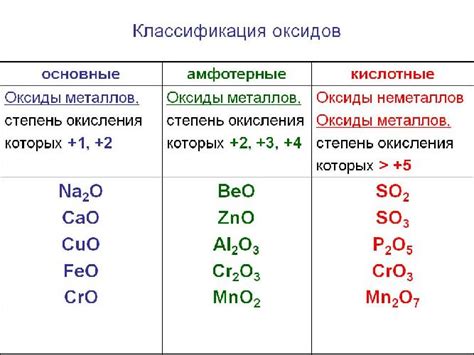
Кислотные оксиды - это химические соединения, которые образуются при соединении металла с кислородом. Обычно металлы, не являющиеся активными, образуют кислотные оксиды.
Кислотные оксиды имеют свойства кислоты и растворяются в воде, образуя кислотные растворы. При этом они способны реагировать с щелочами, нейтрализуя их.
Примеры кислотных оксидов включают оксиды таких металлов, как алюминий, железо, цинк и магний. Например, оксид железа (Fe2O3), известный как ржавчина, образуется при окислении железа воздухом. Он растворяется в воде, образуя раствор, который имеет кислотные свойства.
Кислотные оксиды играют важную роль в химических реакциях и промышленных процессах. Например, они используются в производстве стекла, керамики и металлургии.
Для удобства классификации оксидов существует система названия, в которой они могут быть обозначены как оксиды типа МxOy, где М обозначает металл, а x и y - числа, отражающие соотношение элементов.
Важно отметить, что не все металлы образуют кислотные оксиды. Например, щелочные и щелочноземельные металлы образуют основные оксиды, которые образуют гидроксиды в водной среде и имеют щелочные свойства.
В целом, кислотные оксиды являются важными соединениями, которые играют роль во многих химических процессах и имеют широкий спектр применений в различных отраслях промышленности и науке.
Какие металлы образуют кислотные оксиды?

Металлы образуют кислотные оксиды, когда взаимодействуют с кислородом. Кислотные оксиды образуются металлами, которые имеют способность образовывать положительные ионы с высокими зарядами. Такие металлы обычно имеют большую электроотрицательность.
Некоторые из таких металлов включают алюминий, железо, медь, марганец и цинк. Когда эти металлы взаимодействуют с кислородом воздуха или с другими кислородсодержащими соединениями, они образуют кислотные оксиды.
Например, алюминий взаимодействует с кислородом и образует алюминиевый оксид (Al2O3), который является кислотным оксидом. Железо взаимодействует с кислородом и образует железный оксид (Fe2O3), который также является кислотным оксидом.
Эти кислотные оксиды дальше могут реагировать с водой, образуя кислоты. Например, образование серной кислоты (H2SO4) из оксида серы (SO3) или образование фосфорной кислоты (H3PO4) из оксида фосфора (P2O5).
В целом, металлы, имеющие большую электроотрицательность и способные образовывать положительные ионы с высокими зарядами, образуют кислотные оксиды, которые могут дальше реагировать с водой и образовывать кислоты.
Вопрос-ответ

Какие металлы образуют кислотные оксиды?
Некоторые металлы, такие как Железо (Fe), Медь (Cu), Свинец (Pb) и Алюминий (Al), могут образовывать кислотные оксиды.
Какие другие оксиды могут образовываться у металлов?
У металлов могут образовываться различные типы оксидов, включая щелочные оксиды (основные), нейтральные оксиды и амфотерные оксиды.
