Электронные формулы атомов простых веществ металлов играют ключевую роль в понимании и изучении их основных свойств. Металлы являются одной из самых важных групп веществ в химии, и их электронные формулы отражают особенности структуры и поведения атомов этих элементов.
Атом металла состоит из ядра, которое содержит протоны и нейтроны, и облака электронов, которые находятся вокруг ядра. Электронное облако состоит из энергетических уровней, на которых находятся электроны. Каждый энергетический уровень может содержать ограниченное количество электронов.
Особенностью электронных формул атомов простых веществ металлов является то, что на последних энергетических уровнях находится малое количество электронов. Благодаря этому, металлы обладают высокой электропроводностью и теплопроводностью, а также другими характерными свойствами, такими как блеск, пластичность и хорошая термическая и электрическая проводимость.
Электронные формулы металлов можно представить в виде обобщенной формулы "Ns^2(n-1)d^1", где N - номер энергетического уровня, s - орбиталь s, n - основное квантовое число, d - орбиталь d. Такая формула позволяет определить распределение электронов в энергетических уровнях металла и предсказать его основные физические и химические свойства.
Построение электронных формул атомов металлов
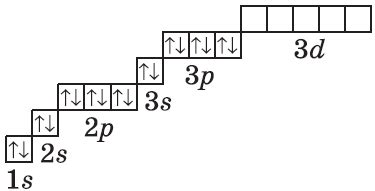
Электронная формула атома металла - это способ графического представления распределения электронов в его электронных оболочках. Построение электронных формул позволяет визуализировать количество электронов на каждом энергетическом уровне и их распределение по подуровням.
Для построения электронных формул атомов металлов необходимо знать конфигурацию электронов в атоме. Конфигурация электронов показывает, в каком порядке электроны занимают энергетические уровни и подуровни. Для металлов характерно наличие нескольких энергетических уровней и подуровней, на которых могут находиться электроны.
Наиболее простым способом построения электронной формулы атома металла является использование электронной конфигурации, которая записывается в виде последовательности чисел и букв. Каждое число обозначает энергетический уровень, а буква указывает подуровень, на котором находятся электроны.
Например, электронная конфигурация атома натрия (Na) может быть записана как 1s² 2s² 2p⁶ 3s¹. Построение электронной формулы атома натрия начинается с рисования ядра атома, обозначаемого символом Na. Затем на каждом энергетическом уровне рисуются оболочки, соответствующие числам в электронной конфигурации. В каждой оболочке указывается количество электронов, находящихся на данном энергетическом уровне и подуровне, обозначаемом буквой. В случае атома натрия на первом энергетическом уровне находятся 2 электрона, на втором - 8 электронов, на третьем - 1 электрон.
Таким образом, построение электронной формулы атома металла позволяет легче представить распределение электронов в его электронных оболочках и понять особенности его строения. Электронные формулы металлов часто используются в химии для обозначения их свойств и изучения химических реакций, в которых они участвуют.
Конфигурация электронных оболочек
Конфигурация электронных оболочек металлов, таких как натрий (Na), железо (Fe) или медь (Cu), имеет определенные особенности, которые отличают их от других элементов. Внешняя электронная оболочка металлов часто содержит только один или два электрона, что делает их относительно нестабильными и склонными к реакциям с другими элементами.
Для простых веществ металлов характерна наличие сильно заполненной s-оболочки, которая обеспечивает им высокую подвижность электронов и хорошую проводимость электричества и тепла. Кроме того, у металлов на внутренних оболочках меньше электронов, что способствует их активности в химических реакциях.
Например, у натрия внешняя электронная оболочка содержит один электрон в s-подуровне. Этот электрон легко отделяется и делает натрий активным металлом, способным образовывать ион Na+ с положительным зарядом в химических реакциях.
С другой стороны, у железа и меди внешние электронные оболочки содержат по два электрона в d-подуровне. Это обеспечивает им высокую степень устойчивости и делает эти металлы практически неподверженными окислению или коррозии. Кроме того, наличие таких электронов в d-подуровне обеспечивает железу и меди способность образовывать разнообразные соединения с различными степенями окисления.
Основные химические свойства металлических атомов

Металлические атомы обладают рядом характерных химических свойств, которые отличают их от атомов других элементов.
Во-первых, металлические атомы обладают высокой электронной проводимостью. Это связано с их специфической структурой: внешние электроны металлических атомов образуют так называемый "море свободных электронов", которые свободно передвигаются по кристаллической решетке металла. Благодаря этому свойству металлы являются хорошими проводниками электричества и тепла.
Во-вторых, металлические атомы обладают высокой химической активностью. Они легко вступают в химические реакции, образуя соединения с другими элементами. Это связано с тем, что металлические атомы имеют малое количество внешних электронов, что делает их нестабильными. Для достижения более стабильной электронной конфигурации металлы образуют соединения, отдавая свои электроны или вступая в координационные связи.
В-третьих, металлические атомы обладают высокой термической и химической устойчивостью. Они способны выдерживать высокие температуры без расплавления или испарения, а также они устойчивы к воздействию большинства химических реагентов. Это делает металлы незаменимыми материалами для производства различных изделий и конструкций, а также для использования в различных отраслях промышленности и технологии.
Таким образом, металлические атомы обладают уникальными химическими свойствами, которые позволяют им широко использоваться в различных сферах человеческой деятельности. Знание основных характеристик и свойств металлов позволяет эффективно использовать их в различных процессах производства и научных исследованиях.
Вопрос-ответ

Какие металлы имеют особенности в электронных формулах атомов?
Особенности в электронных формулах атомов имеют простые вещества металлов из s- и p-блоков периодической системы.
Какие именно особенности можно увидеть в электронных формулах атомов металлов?
В электронных формулах атомов металлов можно увидеть, что у них внешний электронный слой(валентный)частично заполнен, что делает их химически активными.
Почему металлы имеют такую особенность в электронных формулах атомов?
Металлы имеют такую особенность в электронных формулах атомов из-за их внутренней структуры атомов и расположения электронов в энергетических уровнях. Это делает их стабильными, но в то же время химически активными.
Как электронные формулы атомов металлов влияют на их химические свойства?
Электронные формулы атомов металлов влияют на их химические свойства в том смысле, что они определяют возможность металла образовывать соединения и взаимодействовать с другими веществами.
Какие закономерности можно наблюдать в электронных формулах атомов простых веществ металлов?
В электронных формулах атомов простых веществ металлов можно наблюдать закономерности в количестве валентных электронов, которые определяют химические свойства и возможность образования соединений.
