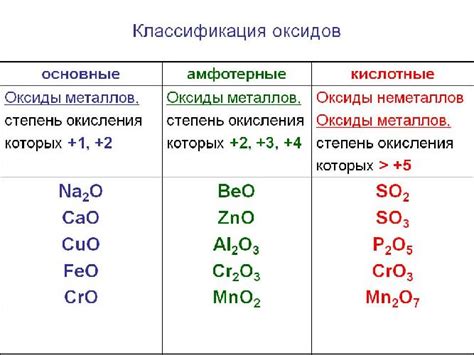
Амфотерные оксиды металлов – это вещества, которые обладают свойствами как кислот, так и щелочей. Такие оксиды способны реагировать как с кислотными, так и с щелочными реагентами, образуя соли. В данной статье рассмотрим амфотерные оксиды металлов с уровнем окисления 2.
С единицей окисления равной 2 амфотерные оксиды встречаются у многих металлов, например, у железа (FeO), цинка (ZnO), свинца (PbO), меди (CuO) и др. Все эти вещества обладают способностью образовывать как соли с кислотами, так и соли с щелочами.
Амфотерные оксиды металлов с уровнем окисления 2 имеют важное применение в различных областях. Например, оксид железа (FeO) используется в производстве магнитных материалов и катализаторов. Оксид цинка (ZnO) широко применяется в производстве резин, лаков, красок, стекла, а также в косметической и фармацевтической промышленности.
Свойства и применение амфотерных оксидов металлов с уровнем окисления 2

Свойства
Амфотерные оксиды металлов с уровнем окисления 2 обладают способностью проявлять кислотные и основные свойства в зависимости от условий среды. Это свойство обусловлено наличием в их структуре свободных электронов, что позволяет им взаимодействовать как с кислородом, так и с ионами водорода.
Такие оксиды обычно проявляют амфотерность при растворении в различных кислотах и щелочах, образуя соли. Для них характерны различные окислительные состояния металла, что позволяет им выполнять различные функции в химических процессах.
Применение
Амфотерные оксиды металлов с уровнем окисления 2 широко используются в различных областях.
Одно из основных применений – это использование таких оксидов в производстве керамики. Их свойства позволяют создавать материалы с высокой прочностью, устойчивость к высоким температурам и химическим воздействиям. Керамические изделия, полученные на основе амфотерных оксидов металлов, применяются в авиационной и космической промышленности, электронике, а также в производстве катализаторов и неорганических полупроводников.
Другое важное применение амфотерных оксидов металлов – это использование их в процессах нейтрализации и очистки воды. Благодаря своим амфотерным свойствам, такие оксиды способны реагировать как с кислыми, так и с щелочными примесями в воде, образуя стабильные безопасные соединения.
Некоторые амфотерные оксиды металлов также применяются в медицине для изготовления имплантатов и медицинских препаратов. Благодаря своим химическим свойствам они способствуют регенерации тканей и имеют антимикробные свойства, что делает их полезными в лечении различных заболеваний.
Амфотерные оксиды: определение и характеристики

Амфотерные оксиды - это класс веществ, которые могут взаимодействовать как с кислотами, так и с щелочами. Термин "амфотерный" происходит от греческого слова "amphoteros", что означает "оба". Это означает, что амфотерные оксиды могут реагировать с кислотами, проявляя свои щелочные свойства, а также с щелочами, проявляя свои кислотные свойства.
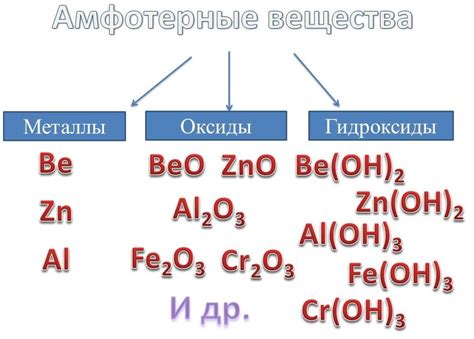
Амфотерные оксиды обладают определенной структурой, которая позволяет им взаимодействовать с разными типами веществ. Они содержат атомы металла, которые могут изменять свою степень окисления и образовывать различные соединения. Наиболее известными амфотерными оксидами являются оксиды металлов с уровнем окисления 2, такие как оксиды алюминия (Al2O3) и цинка (ZnO).
Амфотерные оксиды проявляют свои кислотные свойства при взаимодействии с щелочами. В таких реакциях они образуют соли. Например, оксид алюминия (Al2O3) реагирует с гидроксидом натрия (NaOH), образуя соль - гидроксид алюминия (Al(OH)3). При взаимодействии с кислотами амфотерные оксиды проявляют свои щелочные свойства. Например, оксид цинка (ZnO) реагирует с соляной кислотой (HCl), образуя соль - хлорид цинка (ZnCl2).
Важно отметить, что не все оксиды металлов с уровнем окисления 2 являются амфотерными. Например, оксид магния (MgO) является щелочным оксидом и реагирует только с кислотами, а оксид натрия (Na2O) является кислым оксидом и реагирует только с щелочами. Амфотерные оксиды могут использоваться в различных областях, включая производство стекла, керамики и катализаторов.
Оксиды металлов с уровнем окисления 2: виды и состав
Оксиды металлов с уровнем окисления 2 являются амфотерными веществами, то есть они могут проявлять свойства как оснований, так и кислот. Обычно они представляют собой бинарные соединения металлов и кислорода.
Одним из самых распространенных оксидов с уровнем окисления 2 является оксид железа (II), который также известен как FeO. Он образуется при нагревании железа в атмосфере с недостатком кислорода. Данный оксид обладает черным цветом и образует структуру кристаллическую решетку.
Еще одним примером оксида с уровнем окисления 2 является оксид меди (II), или CuO. Этот оксид представляет собой черный порошок, который обладает свойствами как основания, так и кислоты. Он активно используется в различных химических процессах, включая каталитические реакции и электрохимические процессы.
Кроме того, существует также оксид свинца (II) - PbO. Этот оксид имеет желто-коричневый цвет и используется в различных областях промышленности, таких как производство стекла и керамики.
В общем, оксиды металлов с уровнем окисления 2 представляют собой важный класс соединений, которые имеют широкий спектр применения в различных сферах науки и промышленности.
Амфотерные оксиды и их реакция с кислотами
Амфотерные оксиды - это оксиды металлов с уровнем окисления 2, которые могут взаимодействовать как с кислотами, так и с щелочами. Они обладают свойствами иосооксионов и оснований, что делает их уникальными в химических реакциях.
Первое свойство амфотерных оксидов - их способность образовывать с кислотами соли. При реакции оксида металла с кислотой образуется соль металла и вода. Например, оксид алюминия (Al2O3) реагирует с соляной кислотой (HCl), образуя соль алюминия (AlCl3) и воду.
Второе свойство амфотерных оксидов - их способность образовывать соли с щелочами. При этом металл из оксида замещается гидроксидным ионом из щелочи. Например, оксид алюминия (Al2O3) реагирует с гидроксидом натрия (NaOH), образуя соль алюминия (Al(OH)3) и воду.
Таким образом, амфотерные оксиды металлов с уровнем окисления 2 могут взаимодействовать как с кислотами, так и с щелочами, образуя соли. Они играют важную роль в реакциях внутри организмов, промышленности и природы.
Взаимодействие амфотерных оксидов с щелочами

Амфотерные оксиды металлов с уровнем окисления 2 представляют собой вещества, которые могут проявлять свойства и кислот, и щелочей. Они реагируют не только с кислотами, но и с щелочами, образуя соли.
Когда амфотерные оксиды взаимодействуют с щелочами, образуется соль и вода. Это происходит благодаря способности амфотерных оксидов принимать или отдавать протоны в зависимости от условий реакции.
При взаимодействии амфотерных оксидов с щелочами, атомы металла принимают протоны от щелочей и образуют положительно заряженные ионы металла. В свою очередь, атомы водорода отщепляются от щелочей и образуют отрицательно заряженные ионы гидроксида.
Примером такой реакции может служить взаимодействие оксида алюминия (Al2O3) с гидроксидом натрия (NaOH). При этом образуется соль алюминия и гидроксид алюминия:
| Реагенты | Продукты |
|---|---|
| Al2O3 | 2NaAlO2 + H2O |
Таким образом, взаимодействие амфотерных оксидов с щелочами приводит к образованию солей и гидроксидов металлов, что демонстрирует их амфотерные свойства.
Применение амфотерных оксидов металлов с уровнем окисления 2

Амфотерные оксиды металлов с уровнем окисления 2 — это соединения, которые обладают свойствами как оснований, так и кислот.
Их применение широко распространено в различных отраслях промышленности и научных исследованиях. Одним из важных областей применения амфотерных оксидов является производство катализаторов.
Амфотерные оксиды металлов находят применение в производстве электроники и полупроводниковой промышленности. Они используются для создания тонких пленок, необходимых для изготовления микросхем и других электронных устройств.
Также амфотерные оксиды металлов находят применение в производстве керамики, стекла и эмали. Они используются для придания материалам определенных свойств, таких как прочность, устойчивость к коррозии и термическим воздействиям.
Оксиды с уровнем окисления 2 являются важными компонентами в процессах обезжелезивания и очистки воды. Они способны образовывать гидроксиды, которые осаждаются и удаляют различные загрязнения из воды.
Кроме того, амфотерные оксиды металлов с уровнем окисления 2 находят применение в медицине. Они используются в качестве активных ингредиентов в лекарственных препаратах, таких как антибактериальные кремы и противогрибковые средства.
Вопрос-ответ

Какие металлы могут образовывать амфотерные оксиды с уровнем окисления 2?
Амфотерные оксиды металлов с уровнем окисления 2 могут образовываться у таких металлов, как алюминий (Al), кобальт (Co), марганец (Mn), цинк (Zn) и другие.
Чем отличаются амфотерные оксиды от кислых и основных?
Амфотерные оксиды обладают способностью реагировать как с кислотами, так и с щелочами. Они могут образовывать соли и воды как при взаимодействии с кислотами, так и с основаниями. В отличие от кислых и основных оксидов, амфотерные оксиды не имеют жесткой склонности к реакции только с кислотами или только с основаниями.
Какие свойства обусловливают амфотерность оксидов металлов с уровнем окисления 2?
Свойства, обусловливающие амфотерность оксидов металлов с уровнем окисления 2, связаны с электронной структурой металла. Металлы с уровнем окисления 2 имеют электроны в валентной оболочке, которые могут участвовать в химических реакциях и взаимодействовать как с кислотами, так и с основаниями.
