Металлы - это класс химических элементов, обладающих рядом уникальных свойств. Одним из важных аспектов поведения металлов является их взаимодействие с кислородом. Кислород играет важную роль в химических реакциях, включая окислительные процессы, в которых металлы реагируют с воздухом или другими веществами, содержащими кислород.
Обычно металлы хорошо реагируют с кислородом, образуя оксиды. Оксиды металлов могут иметь различные свойства: от твёрдых и хрупких веществ до порошкообразных соединений или даже газообразных веществ. Реакция металла с кислородом часто сопровождается выделением тепла и вызывает окисление металла.
Некоторые металлы, такие как железо и медь, способны образовывать защитную пленку окиси на своей поверхности при взаимодействии с кислородом, что предотвращает дальнейшую коррозию. Это объясняет прочность и надёжность металлических конструкций, изготовленных из этих материалов. Однако не все металлы обладают подобными свойствами и могут быстро окисляться или растворяться при контакте с кислородом, что делает их менее устойчивыми в присутствии воздуха.
Реакция металлов с кислородом

Металлы обладают различной реакционной способностью к кислороду, что определяет их способность образовывать оксиды. Одни металлы проявляют интенсивную реакцию с кислородом, другие металлы реагируют медленно или совсем не реагируют.
Активные металлы, такие как натрий, калий или кальций, реагируют с кислородом быстро и ярко. При взаимодействии с кислородом они образуют оксиды, например оксид натрия (Na2O), оксид калия (K2O) или оксид кальция (CaO). Эти оксиды часто являются щелочными и образуют гидроксиды взаимодействуя с водой.
Некоторые металлы, такие как алюминий, железо и магний, имеют среднюю реакционную способность к кислороду. Они образуют оксиды и гидроксиды, но реакции могут протекать медленно. Например, железо реагирует с кислородом, образуя оксид железа (Fe2O3), который является основным компонентом ржавчины.
Некоторые металлы, такие как серебро или золото, практически не взаимодействуют с кислородом, поэтому они не образуют оксиды и практически не подвержены окислению. Это объясняется их высокой инертностью к кислороду и другим окислителям.
Реакция металлов с кислородом играет важную роль в различных процессах, таких как окисление металлов, горение и дыхание. Понимание реакционной способности металлов помогает в их применении в различных отраслях, от энергетики до химической промышленности.
Окисление металлов

Окисление металлов – это процесс, при котором металлы реагируют с кислородом из воздуха или воды, образуя оксиды. Окисление является одним из важнейших свойств металлов и может происходить как при нормальных условиях, так и при повышенных температурах, под действием силы тока или химических реагентов.
Металлы могут реагировать с кислородом не только при высоких температурах, но и при обычных условиях. Например, железо и алюминий, два из самых распространенных металлов, окисляются под воздействием кислорода воздуха. Этот процесс называется поверхностной окислительной коррозией и приводит к образованию оксидных пленок на поверхности металла.
При окислении металлов происходит изменение их химической структуры. Образующиеся оксиды могут иметь различную окраску, начиная от черных и серых до красных и зеленых. Некоторые оксиды металлов обладают защитными свойствами и предотвращают дальнейшее окисление, а другие могут быть легко удалены механическим или химическим способами.
Окисление металлов может иметь как положительные, так и отрицательные последствия. С одной стороны, оксиды металлов используются в различных отраслях промышленности, например, в производстве красок, стекла и керамики. С другой стороны, окисление может привести к коррозии и разрушению металлических конструкций, что может быть очень дорогостоящим.
Восстановление металлов
Восстановление металлов – это процесс, при котором металлический ион переходит в несовершенную окисленность или полную неподвижность. Восстановление может происходить как при химических реакциях, так и при электрохимических процессах.
Одним из основных способов восстановления металлов является реакция с кислородом. Кислород, будучи сильным окислителем, может реагировать с металлическими ионами, приводя к образованию оксидов металлов. Однако в некоторых случаях металлы могут восстанавливаться в присутствии кислорода, исходящего из окружающей среды.
Некоторые металлы, такие как железо и алюминий, имеют способность к пассивации, то есть образованию пленки оксида на поверхности, которая предотвращает дальнейшее окисление. Эта пленка играет роль защитного слоя и обеспечивает стабильность металла в агрессивной среде.
Восстановление металлов может показаться негативным процессом, поскольку оно приводит к коррозии металла. Однако в некоторых случаях восстановление металлов может быть полезным. Например, восстанавливая ион металла, можно получить чистый металл, который может использоваться в производстве различных изделий.
Таким образом, восстановление металлов является важным процессом, который имеет как положительные, так и отрицательные аспекты. Знание свойств металлов в отношении кислорода позволяет контролировать процессы восстановления и использовать металлы в различных областях промышленности и науки.
Коррозия металлов

Коррозия металлов - это процесс непростого взаимодействия металлов с окружающей их атмосферой, приводящий к разрушению металлической поверхности под воздействием кислорода.
Одной из основных причин возникновения коррозии является активность металлов кислорода. Кислород окружает нас повсюду, и поэтому металлы подвержены его воздействию, особенно при повышенной влажности.
Особенностью металлов является их способность к окислительно-восстановительным реакциям. Металлы активно взаимодействуют с кислородом, образуя оксиды, которые являются основой коррозии. Оксиды металлов образуют пленку на поверхности металла, которая служит барьером для дальнейшего окисления, но с течением времени эта пленка может разрушаться и проникновение кислорода начинается снова. В результате металл постепенно разрушается.
Эпитаксиальная или адгезионная коррозия - это еще один вид коррозии металлов. Она возникает при разнице состава атомов ионной сетки органогенных и неорганических материалов, таких как соли, газы и пр. Механизм такого воздействия определяется свойствами поверхности и кристаллической структурой металла, а также физико-химическими параметрами контактирующих материалов.
Общей мерой оценки сопротивляемости металлов коррозии является величина рабочего потенциала (эрза). Этот параметр определяет скорость окисления и восстановления металла, его способность противостоять коррозии. Металлы с высоким рабочим потенциалом имеют малую склонность к коррозии, а те, у которых данный параметр низкий, считаются более коррозионно-устойчивыми.
Металлы как катализаторы окислительных реакций
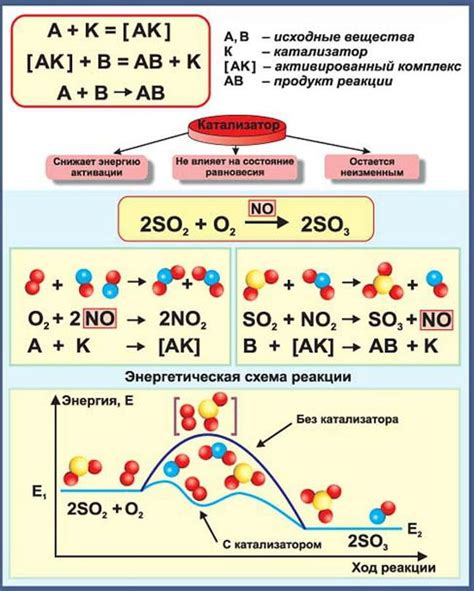
Катализаторы - это вещества, которые ускоряют скорость химических реакций, не участвуя в самих реакциях. Одним из классов таких катализаторов являются металлы.
Металлы обладают рядом уникальных свойств, которые делают их эффективными катализаторами окислительных реакций. Одно из таких свойств - высокая проводимость электричества. Высокая проводимость позволяет металлам участвовать в электронных переносах при окислительно-восстановительных реакциях.
Еще одним важным свойством металлов является способность образовывать соединения с различными видами кислорода. Например, металлы могут образовывать оксиды, пероксиды, супероксиды и другие соединения. Такие соединения обладают активностью и способны участвовать в окислительных реакциях.
Для эффективности катализатора металлы должны иметь большую поверхность, чтобы обеспечить максимальный контакт между реагентами. Повышение поверхностной площади металла достигается за счет использования пористых структур или наночастиц.
Применение металлов в качестве катализаторов окислительных реакций имеет широкий спектр применений. Они используются в процессах очистки воды и воздуха, в производстве химических веществ, в энергетической промышленности и других отраслях. Каталитические свойства металлов являются важной особенностью, которая вносит значительный вклад в развитие различных сфер человеческой деятельности.
Влияние кислорода на физические свойства металлов
Кислород является одним из важнейших агентов окисления для металлов. Воздействие кислорода способно значительно изменить физические свойства металлов, что может привести как к полезным, так и к негативным эффектам.
Один из наиболее заметных эффектов воздействия кислорода на металлы – образование оксидной пленки, которая защищает поверхность металла от дальнейшей коррозии. Например, алюминий сразу после окисления образует плотный слой оксида, который предотвращает продвижение кислорода вглубь металла. В результате металл приобретает дополнительную стойкость к разрушению и повышается его срок службы.
Однако, влияние кислорода на металлы также может иметь негативные последствия. В некоторых случаях, окисление металла может привести к его коррозии и разрушению. Например, вольфрам, который образует плотную оксидную пленку, может подвергаться окислительному разрушению при высоких температурах. Это может привести к ухудшению механических свойств металла и повышению его хрупкости.
Кроме физических свойств, воздействие кислорода на металлы также может изменить их электрические свойства. Например, окисление металла может увеличить его электрическое сопротивление, что может быть полезным в различных электронных приборах и устройствах. Окисленные металлы также могут обладать особыми магнитными свойствами, что делает их привлекательными для использования в магнитных материалах и датчиках.
Вопрос-ответ

Какие металлы не реагируют с кислородом?
Некоторые металлы, такие как золото и серебро, не реагируют с кислородом в обычных условиях, поэтому они остаются стойкими и сохраняют свою металлическую блескость даже при длительном контакте с воздухом.
Почему некоторые металлы ржавеют?
Некоторые металлы, такие как железо, алюминий и цинк, могут реагировать с кислородом из воздуха и образовывать окисные покрытия, известные как ржавчина. Ржавеющие металлы становятся хрупкими и теряют свою металлическую блескость.
Какие свойства металлов способствуют их окислению?
Металлы, обладающие более низкой электроотрицательностью, более активно реагируют с кислородом и склонны к окислению. Кроме того, более мягкие или неплотные металлы могут легче подвергаться окислению, так как кислород может проникать в их структуру и образовывать окисные покрытия.
Как металлы реагируют с кислородом под высокой температурой?
При высоких температурах многие металлы могут сгорать в присутствии кислорода. Например, магний и алюминий могут гореть с ярким светом при взаимодействии с кислородом, образуя соответствующие оксиды. Эта реакция может использоваться для получения покрытий металлических изделий.
