Металлы — это класс элементов периодической таблицы химических элементов, который обладает рядом особых физических и химических свойств. Однако существуют и редкие исключения, когда элементы, хоть и принадлежат к классу металлов, не обладают типичными физическими свойствами металлов. Эти элементы находятся в уникальной позиции, в которой их химические свойства говорят о принадлежности к классу металлов, но физические свойства отличаются от типичных для металлов.
Одним из примеров таких элементов является Железо, Fe. Оно относится к классу металлов и имеет химические свойства металлов, такие как реактивность и способность образовывать ионные соединения. Однако физические свойства Железа отличаются от типичных металлических свойств. Например, Железо имеет относительно низкую плотность и немагнитные свойства в некоторых его аллотропных формах.
Другим интересным примером таких элементов является Магний, Mg. Он является металлом, но имеет относительно низкую плотность и очень легкий вес. В связи с этим, Магний находит широкое применение в авиационной и автомобильной промышленности, где его легкость и прочность являются преимуществами. Хотя физические свойства Магния отличаются от типичных металлических свойств, его химические свойства подтверждают его принадлежность к классу металлов.
Особенности химических свойств металлов

Металлы обладают рядом характерных химических свойств, которые отличают их от других элементов. Одной из особенностей металлов является их способность образовывать положительные ионы. Как правило, металлы имеют низкую электроотрицательность, что делает их наклонными к потере электронов и образованию положительно заряженных ионов. Это обусловлено особенностями строения и расположения электронов в атоме металла.
Взаимодействуя с другими веществами, металлы проявляют свою химическую активность. Они могут образовывать соединения с не металлами, такие как оксиды, сульфиды, хлориды и другие. Кроме того, металлы способны образовывать соли с кислотами. Именно благодаря этим свойствам металлы активно используются в различных химических процессах и промышленных производствах.
Металлы имеют высокую теплопроводность и электропроводность, что делает их очень важными материалами для создания электрических и тепловых проводов. Эти свойства определяются наличием свободных электронов в структуре металла, которые свободно перемещаются по металлической решетке и могут проводить тепло и электричество. В связи с этим, металлы широко используются в производстве проводников, электродов и других электронных компонентов.
Большинство металлов способны образовывать сплавы, то есть смеси двух или более металлов. Это обусловлено их способностью образовывать искусственные кристаллические решетки, в которых атомы одного металла находятся рядом с атомами другого металла. Сплавы обладают новыми свойствами, которые не присутствуют у чистых металлов, и применяются в различных отраслях промышленности, таких как авиация, машиностроение, химическая и энергетическая промышленность.
Электронная структура металлов

Электронная структура металлов определяет их химические и физические свойства. В отличие от неметаллов, у металлов валентные электроны свободны и могут двигаться по всей структуре кристаллической решетки. Это обусловлено особыми энергетическими уровнями электронов.
У металлов на последнем энергетическом уровне находятся лишь несколько электронов, что обуславливает их высокую электропроводность и металлический блеск. Кроме того, наличие свободных электронов в металле позволяет ему образовывать ионные связи с другими веществами.
Свободные электроны могут перемещаться под действием электрического поля вдоль структуры кристалла, что обуславливает электропроводность металлов. Этот эффект называется металлической связью или тепловым движением электронов.
Электронная структура металлов может быть описана с помощью энергетической диаграммы. На диаграмме каждый энергетический уровень представлен в виде линии, а электроны располагаются на этих уровнях. Уровни могут быть заполнены до определенной энергии, называемой уровнем Ферми.
Образование ионов металлов

Металлы в химии являются отличными проводниками электричества и тепла, имеют блестящую поверхность и обладают характерными физическими свойствами. Однако некоторые элементы металлов могут образовывать ионы, лишенные этих свойств, иными словами без некоторых физических характеристик. В химических соединениях металлы могут образовывать положительно заряженные ионы, которые называются катионами.
Для образования катионов металлы отдают электроны другим атомам или молекулам, в результате чего их собственный оболочечный состав становится неполным. Чаще всего катионами становятся металлы, которые находятся в левой части Периодической системы Д.И. Менделеева, такие как натрий, калий или железо. Эти металлы образуют однозарядные катионы, отдают один электрон и при этом получают недостающую оболочку.
Однако в некоторых случаях металлы могут образовывать двухзарядные или даже многозарядные катионы. Например, железо может образовывать двухзарядные ионы Fe2+, Fe3+, а медь может образовывать одно или двухзарядные ионы Cu+ и Cu2+. Образование многозарядных ионов связано с потерей большего количества электронов и расширением оболочечной структуры, что приводит к изменению физических свойств металла.
Окислительно-восстановительные свойства металлов

Окислительно-восстановительные свойства металлов являются одними из основных свойств, определяющих химическую активность металлов. Они определяют способность металла активно взаимодействовать с другими веществами, изменяя свою степень окисления.
Металлы могут выступать в реакциях как окислителями, способными отдавать электроны, так и восстановителями, способными принимать электроны. Это обусловлено особенностью внешней электронной оболочки атома металла, состоящей из одного, двух или нескольких электронов. При реакции окисления металл отдает электроны, становясь положительно заряженным ионом, а при реакции восстановления металл принимает электроны, образуя отрицательно заряженный ион или нейтральное соединение.
Окислительно-восстановительные свойства металлов также проявляются в их способности образовывать соли, где металл выступает в роли иона положительной заряды. Это позволяет металлам эффективно использоваться в различных процессах, например, в электрохимии или в производстве различных продуктов и материалов.
В таблице химических элементов Д.И. Менделеева металлы расположены слева от границы, отделяющей их от неметаллов. В связи с этим, окислительно-восстановительные свойства металлов можно рассматривать как характеристику их принадлежности к металлическому типу элементов и их способности вступать в окислительно-восстановительные реакции с неметаллами или другими металлами.
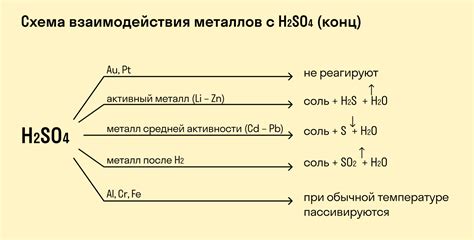
Реакция металлов с кислотами

Реакция металлов с кислотами является одним из важных участников химических процессов. Металлы, будучи химическими элементами, обладают уникальными свойствами, особенно взаимодействием с кислотами. В результате этой реакции образуются соли и выделяется водород.
Кислоты представляют собой вещества, способные отдавать протоны, образуя ион гидрогена (H+). Когда металл контактирует с кислотой, металлические ионы отдают электроны образуя катионы, а кислотные ионы принимают электроны, образуя молекулы водорода. Таким образом, металл реагирует с кислотой и образует соль, а также выделяется водородный газ.
Некоторые металлы, такие как калий, натрий и кальций, очень активно реагируют с кислотами, например, с соляной кислотой (HCl). При этом образуются соответствующие соли и выделяется водород. Другие металлы, такие как железо или алюминий, малоактивны и реагируют с кислотами только при нагревании или в присутствии активного катализатора.
Реакция металлов с кислотами имеет широкое применение как в химическом производстве, так и в повседневной жизни. Например, металлический натрий реагирует с серной кислотой (H2SO4) при производстве гидрогена для использования в различных промышленных процессах. Также реакция металлов с кислотами может использоваться для очистки и обеззараживания поверхностей, так как образующиеся соли обычно являются растворимыми и легко удаляются с поверхности.
Реакция металлов с основаниями
Реакция металлов с основаниями представляет собой процесс, при котором происходит образование солей и выделение водорода. Основания - это химические вещества, способные отдавать гидроксидные ионы OH- в растворах.
В ходе реакции металл с основанием образуется металлическая соль и выделяется молекулярный водород. Происходит замещение катиона металла в основании и образование нового соединения. Реакция может протекать только с определенными металлами, так как некоторые из них не способны реагировать с основаниями.
Реактивность металлов при взаимодействии с основаниями зависит от их положения в электрохимическом ряду. Чем ниже металл расположен в ряду, тем более активной будет реакция. Например, щелочные металлы (натрий, калий) реагируют с основаниями очень активно, а некоторые пассивные металлы (алюминий, цинк) реагируют слабо или вообще не реагируют.
При проведении реакции металла с основанием необходимо обеспечить доступ кислорода, так как в реакции с одним основанием основной продукт - соль, а с воздухом может образовываться окислитель гидроксида. Кроме того, реакция металлов с основаниями может сопровождаться выделением большого количества энергии в виде тепла и света.
Реакция металлов с водой

Многие металлы проявляют активность при взаимодействии с водой. Во время этой реакции металлы отдают электроны и образуют ионы металла в положительном окислительном состоянии. Самой известной реакцией металлов с водой является диспропорционирование водорода. При этом металл образует соль металла и выделяет водород.
Активность металлов при реакции с водой зависит от их электрохимического потенциала. Каллий, натрий и литий являются самыми активными металлами, и реакция с водой у них проходит очень быстро и ярко. Такие металлы как медь, серебро и золото, будучи менее активными, реагируют с водой медленно или не реагируют вообще.
Реакция металлов с водой проходит по следующей схеме: металл + вода -> металлоксид + водород. Например, натрий реагирует с водой с образованием гидроксида натрия и выделением водорода: 2Na + 2H2O -> 2NaOH + H2.
Реакция металлов с водой может быть также сопровождена выделением тепла и пламени, особенно при взаимодействии активных металлов. Некоторые металлы, такие как калий и натрий, могут реагировать с водой даже взрывоопасно, поэтому при проведении экспериментов необходимо соблюдать особое осторожность и принимать все необходимые меры безопасности.
Вопрос-ответ

Какие элементы считаются металлами в химии?
В химии металлами считаются элементы, которые находятся слева от линии, проведенной в таблице химических элементов по диагонали от бора до астатина. Все остальные элементы считаются неметаллами.
Какие физические свойства характерны для металлов?
Металлы обладают рядом уникальных физических свойств. Они обычно обладают блеском, хорошей тепло- и электропроводностью, высокой пластичностью и твердостью. Они также обладают высокой плотностью и точкой плавления, а также способностью образовывать положительные ионы.
