Периодическая таблица химических элементов является основой для изучения химических свойств и структуры вещества. В ней элементы разделены на несколько категорий в зависимости от их свойств и химической активности. Одной из основных групп элементов в таблице являются металлы, которые занимают большую часть таблицы. Однако некоторые элементы, расположенные справа от водорода, также являются металлами, хотя обладают отличными от традиционных металлов свойствами.
Первым таким элементом является группа элементов, известных как побочные металлы, которые находятся между металлами и неметаллами. К ним относятся элементы такие как алюминий, кремний, фосфор и сера. Хотя они обладают некоторыми металлическими свойствами, такими как теплопроводность и электропроводность, они также имеют неметаллические свойства, такие как низкую плотность и низкую температуру плавления.
Другой группой металлов, расположенных справа от водорода, являются платиновые металлы. К ним относятся элементы родий, рутений, палладий, иридий, осмий и платина. Они отличаются высокой плотностью, твердостью и стойкостью к коррозии. Они широко используются в промышленности, включая производство катализаторов, электродов и ювелирных изделий.
Вещества недавно открытые искателями драгоценных металлов
В периодической таблице элементов производства тяжёлых и платиновых металлов, справа от водорода находится группа элементов, которые недавно стали объектом исследований и привлекли внимание искателей драгоценных металлов. Это вещества, обладающие уникальными свойствами и потенциалом для промышленного использования.
Одним из таких веществ является иридий. Этот металл относится к платиновой группе и обладает высокой плотностью, прочностью и стабильностью. Иридий обнаружен в различных виде драгоценных камней и сплавов, и его изучение открыло новые перспективы для применения в высокотехнологичных областях, таких как электроника и медицина.
Еще одним представителем этой группы металлов является резерфордий. Впервые полученный в 1964 году, этот элемент обладает высокой плотностью и является одним из самых тяжелых элементов в природе. Резерфордий представляет интерес для научных исследований, и его химические свойства помогают расширить наши знания о строении и свойствах атомов.
Другим интересным веществом из этой группы является дубний. Этот тяжёлый металл был открыт в 1970 году и химически обладает уникальными свойствами. Дубний показывает некоторые признаки металлов, но также проявляет и свойства полуметаллов. Изучение дубния позволяет расширить наши знания о переходных элементах и их вариациях в периодической таблице.
Таким образом, вещества из группы металлов, расположенных справа от водорода в периодической таблице, представляют интерес для исследований и обладают потенциалом для промышленного применения. Они открывают новые возможности в высокотехнологичных областях и способствуют расширению наших знаний о химических элементах и их свойствах.
Легкая проводимость электричества металлов

Металлы, расположенные справа от водорода в периодической таблице, обладают особым свойством - легкой проводимостью электричества. Это связано с особенностью их электронной структуры.
В атомах металлов, таких как железо, медь или алюминий, электронная оболочка состоит из нескольких уровней, на которых находятся электроны. Внешний уровень оболочки называется валентным уровнем. На нем находится малое количество электронов, что делает атомы металлов нестабильными и склонными к образованию ионов.
Однако в металлах, кроме ионного типа связи, существует еще один тип связи - металлическая связь. Она основана на взаимодействии свободных электронов, находящихся на валентном уровне, с положительно заряженными ионами металла. Свободные электроны образуют "электронное облако", которое двигается по всему объему металла.
Именно благодаря наличию свободных электронов металлы обладают легкой проводимостью электричества. Когда на металлический материал подается электрическое напряжение, свободные электроны в нем начинают двигаться под действием силы электрического поля. Таким образом, проводимость электричества в металлах является следствием движения свободных электронов.
Такое свойство металлов широко используется в различных областях, например, в электротехнике и электронике. Оно позволяет изготавливать провода, контакты и различные элементы электрических цепей из металлов, обеспечивая надежное и эффективное соединение и передачу электрического тока.
Значение и применение металлов в промышленности

Алюминий является одним из наиболее распространенных и востребованных металлов в промышленности. Его легкость, прочность и коррозионная стойкость делают его идеальным материалом для производства авиационных, автомобильных и строительных конструкций. Алюминий также широко используется в производстве упаковочных материалов, электротехники и кухонной посуды.
Медь является одним из самых важных металлов в промышленности. Она обладает высокой электропроводностью, что делает ее идеальным материалом для производства электрических проводов и кабелей. Медь также используется в производстве трубопроводов, систем отопления и охлаждения, медицинского оборудования и музыкальных инструментов.
Цинк имеет широкое применение в промышленности благодаря своим антикоррозионным свойствам. Он используется в производстве защитных покрытий для стальных строительных конструкций, труб и автомобилей. Цинковые покрытия также применяются в производстве батарей, солнечных панелей, косметических и фармацевтических продуктов.
Железо является основным материалом для производства стали, которая широко используется в строительной, автомобильной и судостроительной промышленности. Железо также применяется в производстве мебели, бытовой техники, инструментов и многих других товаров. Благодаря своей прочности и долговечности, железо является основой для многих инфраструктурных проектов.
Никель широко используется в производстве сплавов, которые обладают высокой прочностью и жаропрочностью. Такие сплавы применяются в авиационной и космической промышленности, в производстве химического оборудования, инструментов и многих других изделий. Никель также используется в производстве монет, ювелирных украшений и электроники.
Кадмий используется в производстве аккумуляторов, специальных покрытий и пигментов для красок и пластиковых изделий. Этот металл также находит применение в производстве солнечных батарей, ядерных реакторов и радаров. Кадмий является важным материалом в электротехнике, электронике и аэрокосмической промышленности.
Свойства и химические реакции металлов
Металлы, расположенные справа от водорода в периодической таблице, обладают рядом уникальных свойств и проявляют особые химические реакции.
Одно из характерных свойств этих металлов - их высокая химическая активность. Они легко образуют соединения с другими элементами, особенно с неметаллами. Такие соединения часто имеют ярко выраженный ионный характер.
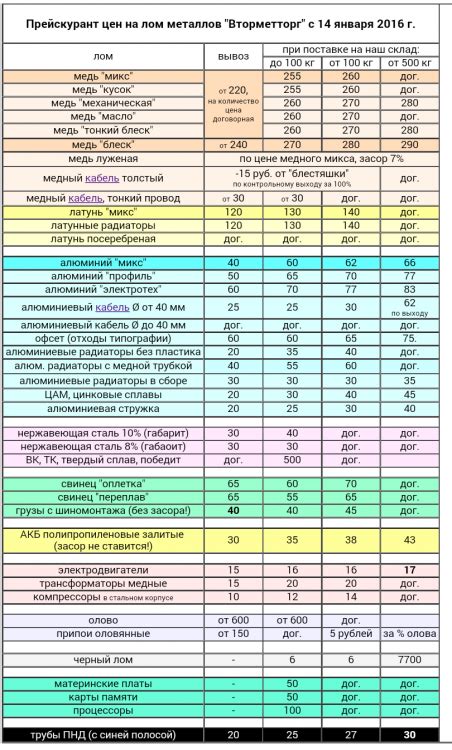
Самым ярким примером химической реакции, проявляемой металлами, является окисление. Металлы справа от водорода обладают высокой склонностью к окислению, они активно взаимодействуют с кислородом из воздуха или воды, что приводит к образованию оксидов и гидроксидов металлов.
Оксиды металлов справа от водорода обычно имеют щелочной характер, т.е. они образуют щелочные растворы, дающие гидроксиды при взаимодействии с водой. Эти растворы обладают щелочной реакцией, то есть их рН превышает 7.
Еще одной характерной реакцией металлов справа от водорода является их способность к реакции с кислотами. Металлы способны оттягивать от кислородов воды ради себя, что приводит к образованию водяных растворов кислот, а металлические элементы окисляются.
Реакция металлов с водой и влажным воздухом

Металлы, расположенные справа от водорода в периодической таблице, в большинстве случаев реагируют с водой и влажным воздухом достаточно активно. Однако, степень и характер их реакций могут существенно различаться в зависимости от конкретного металла.
Натрий (Na) является одним из наиболее активных металлов в периодической таблице. При контакте с водой быстро реагирует с образованием гидроксида натрия и выделением водорода. Такая реакция протекает очень быстро и сопровождается эффектом плавающей металлической капли на поверхности воды.
Магний (Mg) также активно реагирует с водой, однако, реакция протекает медленнее, чем у натрия. В результате реакции магния с водой образуется гидроксид магния и выделение водорода. Реакция металла с водой обычно сопровождается образованием белого осадка и изменением цвета среды.
Алюминий (Al) обладает высокой химической стойкостью и не реагирует с водой под обычными условиями. Однако, влажный воздух, содержащий кислород и влагу, может вызывать коррозию на поверхности алюминия. При длительном воздействии влажности и кислорода образуется оксид алюминия, который препятствует дальнейшей коррозии и оберегает металл от глубокого повреждения.
Таким образом, реакция металлов с водой и влажным воздухом зависит от их химических свойств и положения в периодической таблице. Натрий и магний активно реагируют с водой, образуя соответствующие гидроксиды и выделяя водород, в то время как алюминий обладает химической стойкостью и склонен к коррозии влажным воздухом.
Многочисленные примеры металлических соединений
Металлы, расположенные справа от водорода в периодической таблице, образуют многочисленные соединения с другими элементами. Одним из наиболее распространенных примеров металлических соединений являются сплавы. Сплавы – это материалы, состоящие из двух или более металлов, которые обычно имеют лучшие свойства, чем их отдельные компоненты. Например, сплавы железа с различными металлами, такими как никель или хром, используются для создания прочных и коррозионно-устойчивых стали и нержавеющей стали.
Другим примером металлических соединений являются оксиды металлов. Оксиды – это химические соединения, в которых металл связан с кислородом. Они широко распространены в природе и используются во многих промышленных процессах. Например, оксид железа, известный как ржавчина, является одним из наиболее распространенных оксидов и играет важную роль в ржавчинном процессе.
Еще одним примером металлических соединений являются галогениды металлов. Галогениды – это соединения, в которых металл соединен с халогенами, такими как хлор, бром или йод. Эти соединения обычно обладают яркими цветами и используются в производстве красителей и пигментов. Например, галогенид меди – красное соединение, которое широко используется в качестве красителя в керамике и стекле.
Кроме того, металлы, расположенные справа от водорода в периодической таблице, также образуют множество других соединений, включая сульфиды, карбиды, бориды и другие. Эти соединения имеют различные свойства и применяются в различных областях науки и промышленности.
Возможность образования ионов у металлов
Металлы, расположенные справа от водорода в периодической таблице, обладают способностью образовывать ионы. Это связано с их высокой активностью и способностью отдавать электроны при взаимодействии с другими элементами. Образование ионов у металлов может происходить в процессе химических реакций или взаимодействия с веществами.
Металлы, такие как железо, алюминий, медь и цинк, способны образовывать ионы положительного заряда. Это происходит путем отрыва или передачи одного или нескольких электронов от металла к другому элементу. При этом, металл становится положительно заряженным, а элемент, с которым он взаимодействует, получает эти электроны и становится отрицательно заряженным.
Образование ионов у металлов имеет важное практическое значение. Например, положительные ионы металлов играют ключевую роль в электролизе, гальванических элементах и аккумуляторах. Они также могут участвовать в процессах окисления и восстановления в химических реакциях. Кроме того, металлические ионы могут быть использованы в качестве катализаторов для различных химических превращений.
Для образования ионов металлам требуется активная электронная оболочка, которая обеспечивает свободное перемещение свободных электронов. Кроме того, энергия ионизации металлов, то есть энергия, необходимая для отделения электрона, может быть относительно низкой, что способствует образованию ионов. Эти факторы делают металлы уникальными элементами, обладающими свойствами, которые находят практическое применение в различных сферах.
Вопрос-ответ

Какие металлы находятся справа от водорода в периодической таблице?
Металлы, которые находятся справа от водорода в периодической таблице, называются неуравновешенными металлами.
Какие свойства имеют металлы, расположенные справа от водорода в периодической таблице?
Металлы, находящиеся справа от водорода, обычно обладают более низкими температурами плавления и кипения, высокой плотностью, твердостью и электропроводностью. Они также обладают способностью образовывать катионы и обуславливают большую реакционную способность.
