Электролиз – это процесс разложения вещества под действием электрического тока. Он широко используется в химической промышленности для получения различных металлов. Однако не все металлы можно получить при помощи электролиза в водных растворах их солей. Существуют определенные ограничения, связанные с химическими свойствами металлов, которые препятствуют их успешному получению.
Первое ограничение электролиза связано с термодинамическими свойствами металла. Если его окислительный потенциал ниже потенциала водорода, то при электролизе в водных растворах металла будет выделяться водород, а не сам металл. Это свойство относится к металлам, которые находятся ниже водорода в электрохимическом ряду, таким как медь, свинец, никель и другие.
Второе ограничение электролиза связано с химической стабильностью водных растворов солей металлов. Некоторые металлы образуют нестабильные соединения в воде, которые легко разлагаются на элементарные частицы или выделяют вредные газы. Например, бериллий и алюминий образуют нерастворимые гидроксиды, которые затрудняют электролиз. Также, некоторые металлы, такие как калий и натрий, образуют газообразные гидроксиды, которые могут быть взрывоопасными при электролизе.
Таким образом, при использовании водных растворов солей металлов в электролизе есть ряд ограничений, которые могут препятствовать получению определенных металлов. Это можно объяснить их термодинамическими свойствами и химической стабильностью соединений в воде. Несмотря на это, электролиз остается важным методом получения металлов, позволяющим получать широкий спектр продуктов.
Ограничения электролиза: неполучаемые металлы

Процесс электролиза является эффективным способом получения различных металлов из их соединений, однако существуют металлы, неполучаемые при использовании водных растворов их солей.
Один из примеров неполучаемых металлов - алюминий. Водные растворы алюминиевых солей, таких как сульфат алюминия, не могут быть использованы для электролиза. Это связано с тем, что вода разлагается на электроде, образуя кислород и водород, который конкурирует с алюминием за осаждение на катоде. В результате алюминий не может быть получен электролизом в водных растворах его солей.
Еще одним примером металла, неполучаемого при электролизе водных растворов его солей, является магний. Водные растворы магниевых солей, например хлорида магния, также не могут быть использованы для электролиза. При электролизе воды на аноде образуется кислород, а на катоде - водород. В свою очередь магний активно реагирует с кислородом, что мешает его осаждению на катоде.
Таким образом, процесс электролиза имеет определенные ограничения, связанные с невозможностью получения некоторых металлов при использовании водных растворов их солей, таких как алюминий и магний. Для получения этих металлов необходимо использовать другие методы, например, термическую обработку их соединений.
Что такое электролиз и как он работает?
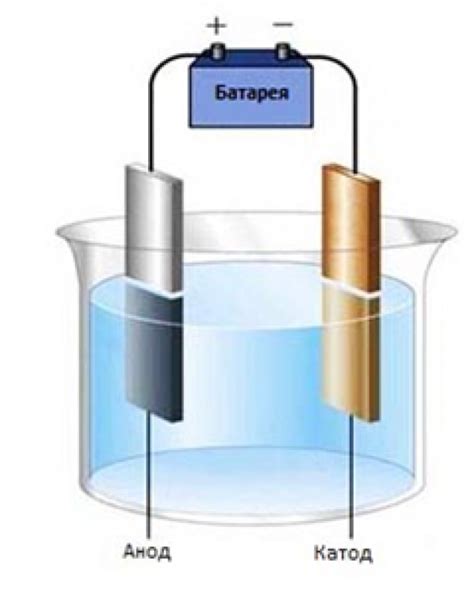
Электролиз - это процесс разложения вещества на ионы при воздействии электрического тока. Для проведения электролиза необходим электролит - вещество, способное проводить электрический ток. Обычно в качестве электролита используют растворы солей или расплавы металлов.
Основными элементами электролиза являются анод и катод. Анод - это положительный электрод, на котором происходит окисление, т.е. отдача электронов. Катод - это отрицательный электрод, на котором происходит восстановление, т.е. принятие электронов.
При подключении источника тока к электролиту, ионы начинают двигаться к положительному или отрицательному электроду в зависимости от их заряда. При достижении электродов, ионы могут претерпевать окисление или восстановление, формируя новые вещества.
Процесс электролиза может применяться для получения различных металлов. Например, при электролизе раствора соли меди на катоде осаждается медь, а на аноде выделяется кислород. Таким образом, при подходящих условиях, электролиз позволяет получать различные металлы из их солей.
Почему некоторые металлы нельзя получить при электролизе водных растворов?
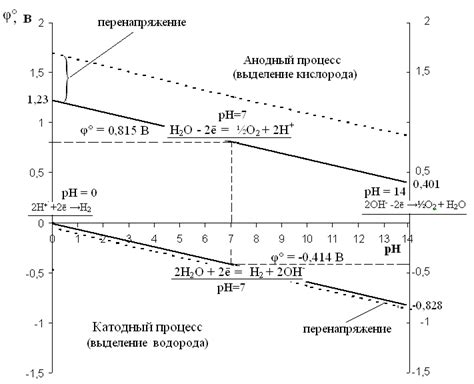
Одним из основных ограничений электролиза водных растворов является невозможность получения некоторых металлов. Это связано с их физико-химическими свойствами и потенциалом окисления. Металлы, которые нельзя получить при электролизе водных растворов, включают алюминий, кальций и магний.
Основной причиной невозможности получения указанных металлов при электролизе водных растворов является их низкий потенциал окисления. В процессе электролиза металлы образуют катионы и двигаются к отрицательному электроду (катоду). Однако некоторые металлы обладают таким низким потенциалом окисления, что водород, имеющий более высокий потенциал, выделяется на катоде вместо металла.
Например, алюминий имеет потенциал окисления -1,66 В, а потенциал окисления водорода составляет всего лишь -0,83 В. Это означает, что при электролизе водного раствора соли алюминия на катоде будет выделяться водород вместо алюминия, в результате чего получить металл будет невозможно.
- Ограничения электролиза водных растворов также связаны с химической активностью металлов.
- Например, кальций и магний обладают сильной химической активностью, что делает их очень реакционными.
- При нагревании водных растворов их солей, металлы кальция и магния реагируют с водой, образуя соответствующие оксиды или гидроксиды, а не осаждаясь на электродах.
- Поэтому, при электролизе водных растворов солей кальция и магния, катодическое осаждение металлов не происходит, и получить их в чистом виде при помощи электролиза водных растворов невозможно.
Таким образом, ограничения электролиза водных растворов связаны с низким потенциалом окисления некоторых металлов, а также их высокой химической активностью. Эти факторы препятствуют получению указанных металлов при использовании электролиза водных растворов и требуют применения других способов получения.
Какие металлы невозможно получить при использовании водных растворов их солей?

Электролиз – один из основных методов получения металлов, особенно широко используется для получения металлов из их водных растворов солей. Однако, не все металлы могут быть получены этим способом.
Один из факторов, ограничивающих возможность получения металлов электролизом, – это их стандартный потенциал окисления. Если стандартный потенциал окисления металла положительный, то этот металл в присутствии водных растворов его солей не может быть получен электролизом. Такие металлы называются нерастворимыми водородом.
Например, таким металлом является золото. Стандартный потенциал окисления золота положительный, поэтому его нельзя получить при использовании водных растворов его солей. Золото может быть получено только из золотоносных руд или других источников, но не электролизом в водных растворах.
Также невозможно получение металлов, обладающих высокой степенью инертности. Например, платина и родий являются металлами с низкой активностью в химических реакциях, что делает их невозможными для получения электролизом в водных растворах их солей.
Таким образом, при использовании водных растворов солей некоторые металлы не могут быть получены электролизом из-за их положительного стандартного потенциала окисления или низкой активности в химических реакциях.
Альтернативные способы получения металлов, недоступных при электролизе водных растворов
Водный электролиз является одним из наиболее распространенных способов получения металлов из их солей. Однако, не все металлы могут быть получены при использовании этого метода.
Некоторые металлы, такие как железо, никель, кобальт и ряд других, нельзя получить при электролизе водных растворов их солей. Это связано с тем, что эти металлы находятся в более низких электрохимических рядах и не обладают достаточной амперностью для электролиза воды.
Однако, существуют алтернативные способы получения данных металлов. Например, можно использовать термический метод. При этом металлы нагревают до высоких температур, чтобы вызвать выделение металлического вещества. Этот метод позволяет получить такие металлы, как железо и никель, но имеет ряд недостатков, таких как высокая энергозатратность и сложность оборудования.
Другой альтернативой является гидрометаллургический метод. Он заключается в растворении металлического окалины в кислотном или щелочном растворе. Затем полученный раствор обрабатывается для получения металлического продукта. Этот метод используется, например, для получения никеля и кобальта из их рудных концентратов.
Также использование специальных реагентов и катализаторов может обеспечить получение некоторых металлов, недоступных при электролизе водных растворов. Например, металлы такие, как медь и серебро, могут быть получены при использовании растворов их органических соединений и специальных катализаторов.
Выводя весь вышеизложенный, несмотря на ограничения электролиза водных растворов металлических солей, существуют альтернативные способы получения металлов, которые позволяют добиться желаемого результата.
Вопрос-ответ

Почему нельзя получить некоторые металлы при использовании водных растворов их солей?
Электролиз – это процесс разложения вещества под действием электрического тока. Однако не все металлы можно получить этим методом. К примеру, некоторые металлы, такие как калий, натрий, кальций и магний, водород и алюминий трудно получить при использовании электролиза водных растворов их солей. Это связано с их химическими свойствами и электрохимической активностью.
Какие металлы нельзя получить при электролизе водных растворов их солей?
При использовании электролиза водных растворов их солей нельзя получить некоторые металлы, такие как калий, натрий, кальций, магний, алюминий и некоторые другие. Это связано с их химическими свойствами и электрохимической активностью. Например, калий и натрий очень реактивны и быстро реагируют с водой, образуя щелочь и выделяя водород. Кальций и магний трудно получить из-за их высокой активности и реакционной способности. Алюминий, в свою очередь, образует оксидную пленку на поверхности, которая затрудняет электролиз.
