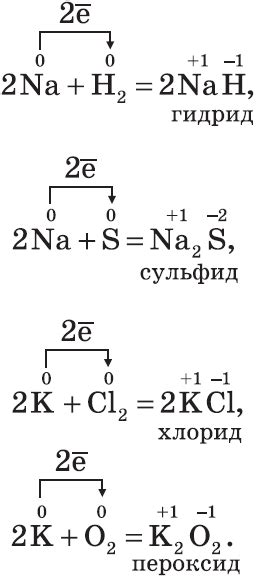
Металлы являются одним из основных классов химических элементов, которые проявляют особое поведение в качестве окислителей и восстановителей. Они обладают способностью взаимодействовать с другими веществами, переходя из одной степени окисления в другую.
В реакциях с неметаллами металлы обычно выступают в качестве восстановителей, передавая электроны другому веществу и тем самым снижая свою степень окисления. Таким образом, металлы проявляют свою реакционную способность и способность быть электронными донорами.
Однако металлы также могут действовать в качестве окислителей, вступая в реакции с металлами более высокой степени окисления или с неметаллами, которые обладают большей способностью принимать электроны. В таких реакциях металлы передают электроны другому веществу и повышают свою степень окисления.
Таким образом, поведение металлов в качестве окислителей и восстановителей определяется их способностью переходить из одной степени окисления в другую и передавать электроны другим веществам. Это свойство металлов играет важную роль во множестве химических реакций и процессов, включая коррозию, гальванические элементы, электролиз и многие другие.
Металлы: механизмы окисления и восстановления
Металлы имеют способность окисляться и восстанавливаться, что обуславливается их структурой и свойствами. Процессы окисления и восстановления металлов могут происходить как в присутствии кислорода, так и без него.
Механизм окисления металлов с кислородом основан на реакции металла с кислородом воздуха. При этом металл отдает электроны кислороду, окисляется и превращается в оксид. Например, железо воздействие кислорода окисляется и образует ржавчину.
Механизм окисления металлов без кислорода связан с реакцией металла с химическими веществами, содержащими активный кислород, например, кислотами. В результате этой реакции металл также отдает электроны и окисляется.
Механизм восстановления металлов обратный процессу окисления. Он основан на реакции передачи электронов от восстановителя к окисленному металлу. Восстановление металлов может происходить как наличии кислорода, так и без него. Например, при восстановлении ионов железа в растворе с помощью восстановителя, металл железо принимает электроны и превращается в металлическую форму.
Умение металлов окисляться и восстанавливаться находит широкое применение в различных областях, включая электрохимию, гальванику, производство металлов и другие технологические процессы. Изучение механизмов окисления и восстановления металлов позволяет более полно понять их свойства и использовать их в различных сферах человеческой деятельности.
Окислитель - что это?

Окислитель - это вещество, которое способно принимать электроны от других веществ, проявляя свои окислительные свойства. Оксидационно-восстановительные реакции являются одним из фундаментальных процессов в химии и имеют большое значение в жизни человека и в природе.
Окислительные свойства металлов проявляются при реакции с другими веществами. Металлы, как правило, обладают способностью отдавать электроны, поэтому они могут выступать в роли окислителей. В процессе окисления металла электроны передаются другим веществам, которые в свою очередь проявляют свои восстановительные свойства.
Металлы, которые проявляют сильные окислительные свойства, могут взаимодействовать с различными веществами, например, с кислородом или с водой. В результате таких реакций происходит образование оксидов — веществ, состоящих из металла и кислорода.
Окислительные свойства металлов можно определить с помощью электрохимических реакций. Конкретный металл может реагировать с другими веществами по-разному, в зависимости от условий реакции и его валентности. Такие свойства металлов дают возможность использовать их в различных технологиях и процессах, например, при производстве металлических сплавов или при коррозии металлических поверхностей.
- Металлы обладают окислительными свойствами.
- Окислитель - это вещество, способное принимать электроны.
- Оксидационно-восстановительные реакции играют важную роль в химии.
- Металлы могут реагировать с кислородом или водой, образуя оксиды.
- Окислительные свойства металлов можно определить экспериментально.
Восстановитель - их роль в химических реакциях

В химических реакциях металлы могут выступать в роли восстановителей, то есть веществ, способных передать электроны другим веществам.
Металлы характеризуются положительным потенциалом окисления, что делает их способными отдавать электроны и восстановливать другие вещества. Такие реакции, где металл передает электроны, называются окислительно-восстановительными реакциями или реакциями восстановления.
Примером окислительно-восстановительной реакции может служить реакция, происходящая при образовании коррозии металла. В таком случае, металл вступает в реакцию с кислородом воздуха и окисляется, теряя электроны, в то время как кислород восстанавливается, приобретая электроны.
Из-за своей способности восстановления металлы широко применяются в различных процессах и технологиях, например, в электрохимических цепях, гальванических элементах, аккумуляторах и так далее. Они также играют важную роль в производстве металлов и сплавов, а также в сельском хозяйстве, например, при использовании металлических соединений в качестве удобрений для растений.
Катализаторы окисления и восстановления
Металлы имеют важную роль в катализаторах окисления и восстановления. Окислительные реакции, в которых одно вещество передает электроны другому, часто требуют наличия катализаторов для ускорения процесса. Катализаторы окисления принимают электроны от веществ, которые окисляются, и передают их на окислитель.
Одним из наиболее распространенных металлических катализаторов окисления является платина. Она широко используется в автомобильных катализаторах, где помогает в процессе окисления вредных выхлопных газов в более безопасные соединения. Другие металлы, такие как палладий и родий, также обладают каталитическими свойствами окисления.
Катализаторы восстановления, наоборот, способны передавать электроны веществам, которые восстанавливаются, и тем самым способствуют ускорению процесса восстановления. Например, никель и железо часто применяются в процессах восстановления органических соединений в химической промышленности.
Важно отметить, что металлические катализаторы могут быть эффективными только в определенном диапазоне условий, таких как температура и давление. Поэтому в различных процессах окисления и восстановления могут применяться разные металлические катализаторы, в зависимости от требований конкретной реакции.
В заключение, металлы играют важную роль как катализаторы окисления и восстановления, способствуя ускорению электронных переносов между веществами. Знание особенностей каждого металлического катализатора помогает определить лучший выбор для конкретного процесса окисления или восстановления.
Примеры металлов-окислителей
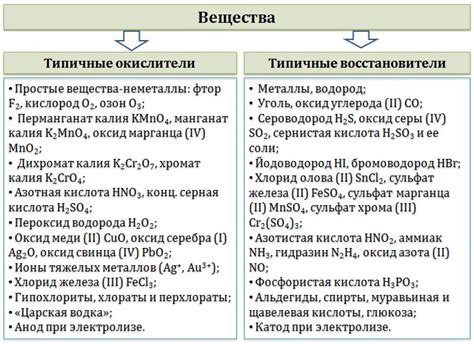
Железо: Железо является одним из наиболее распространенных металлов-окислителей. Оно способно взаимодействовать с кислородом, образуя свои оксиды, такие как FeO (желез(II) оксид) и Fe2O3 (желез(III) оксид).
Медь: Медь также является хорошим окислителем. Она способна реагировать с кислородом и образовывать свои оксиды, такие как CuO (медь(II) оксид) и Cu2O (медь(I) оксид).
Свинец: Свинец может также действовать в роли окислителя. Он может образовывать свои оксиды, такие как PbO (свинец(II) оксид) и PbO2 (свинец(IV) оксид), в реакциях с кислородом.
Алюминий: Алюминий является металлом-окислителем и может реагировать с кислородом, образуя свои оксиды, такие как Al2O3 (алюминий оксид) и AlO (алюминий(III) оксид).
Цинк: Цинк также может действовать как окислитель. Он образует свои оксиды, такие как ZnO (цинк оксид), взаимодействуя с кислородом.
Примеры металлов-восстановителей

Металлы-восстановители – это группа металлов, которые имеют свойство легко отдавать электроны и образовывать ион положительного заряда. Данные металлы обычно находятся внизу в ряду электрохимического ряда напряжений и являются сильными окислителями. Наиболее распространены следующие примеры металлов-восстановителей:
- Алюминий (Al) – это неактивный металл, который способен выступать в роли восстановителя. Он реагирует с многими окислителями, такими как хлор, кислород и даже вода. Наиболее известным примером реакции алюминия с оксидом железа (III) является превращение ржавчины в металлический алюминий.
- Натрий (Na) – металл, который также является сильным восстановителем. Натрий реагирует с водой, выделяя водород и образуя гидроксид натрия. Этот процесс может быть продемонстрирован путем бросания кусочка натрия в воду, что сопровождается ярким свечением и шипением.
- Цинк (Zn) – металл, который также обладает свойством восстановления. Цинк реагирует с кислородом воздуха, образуя оксид цинка. Эта реакция позволяет использовать цинк в анодах гальванических элементов и защитных покрытиях от коррозии.
Это лишь несколько примеров металлов-восстановителей. Эта группа металлов широко используется в различных промышленных процессах и химических реакциях, где требуется передача электронов и восстановление окислителя.
Практическое применение металлов в окислительно-восстановительных реакциях

Металлы широко применяются в окислительно-восстановительных реакциях благодаря своей способности менять свое окислительное состояние. Они могут служить как окислителями, так и восстановителями в химических процессах.
Одним из наиболее распространенных применений металлов в окислительно-восстановительных реакциях является их использование в батареях. Например, в щелочных батареях в качестве окислителя используется кислород, а в качестве восстановителя металл гидридной пленки. Батареи на основе металлов, таких как литий, магний и свинец, имеют высокую энергетическую плотность и широко используются в электронике и автомобильной промышленности.
Металлы также находят применение в процессе гальванизации, который используется для покрытия металлических поверхностей защитным слоем. Например, в процессе цинкования медные или железные изделия погружают в раствор цинка, который служит восстановителем, а металл изделия окисляется. Такая обработка позволяет улучшить коррозионную стойкость поверхностей и предотвратить их окисление.
Помимо этого, металлы находят применение в процессе экстракции металлов из их руд. В данном случае металлы выступают в качестве восстановителей, способствуя окислению металлов в их рудах и последующему их извлечению. Например, при обогащении железных руд металлы, такие как кокс и углерод, используются в качестве восстановителей для удаления кислорода из железного оксида и получения чистого железа.
Вопрос-ответ

Какие металлы могут выступать в роли окислителей?
В качестве окислителей чаще всего выступают активные металлы, такие как натрий, калий, магний, алюминий и др. Они способны отдавать свои электроны, образуя положительные ионы.
Как металлы проявляют себя в роли восстановителей?
Металлы в роли восстановителей способны принимать электроны от окислителей, образуя положительно заряженные ионы. В результате происходит процесс восстановления, при котором металл окисляется, а окислитель восстанавливается.
Какие свойства металлов определяют их способность выступать в роли окислителей?
Способность металлов выступать в роли окислителей зависит от их электрохимической активности. Чем выше активность металла, тем легче для него отдавать электроны и выступать в роли окислителя.
Как металлы взаимодействуют с кислородом в роли окислителя?
Металлы взаимодействуют с кислородом в роли окислителя, образуя оксиды. Однако не все металлы активно реагируют с кислородом, и только самые активные из них могут гореть в кислороде.
Какие металлы проявляют способность к самосожжению на воздухе?
В основном, способность к самосожжению на воздухе проявляют щелочные металлы, такие как натрий, калий и литий. Горение щелочных металлов в воздухе сопровождается ярким пламенем и образованием оксидов металлов.