Металлы – это группа элементов, которая находится в левой части периодической таблицы. Они обладают рядом особенностей, которые делают их уникальными и важными в химии. Металлы характеризуются высокой электропроводностью, теплопроводностью и пластичностью, что делает их идеальными для использования во многих промышленных и технологических процессах.
Примеры металлов включают в себя такие элементы, как железо, алюминий, медь, свинец, золото и многие другие. Каждый металл имеет свои уникальные свойства и применения. Например, железо является основным компонентом стали и используется в строительстве, машиностроении и других областях. Алюминий обладает легкостью и коррозионной стойкостью, что делает его идеальным материалом для производства авиационных и автомобильных компонентов. Золото, благодаря своей уникальной химической инертности и блеску, широко используется в ювелирном искусстве и электронике.
Металлы образуют различные связи с другими элементами, что позволяет им образовывать разнообразные химические соединения. Наиболее распространенной связью у металлов является ионная связь, при которой металлический элемент отдает электроны, образуя положительно заряженные ионы, а неметаллический элемент получает эти электроны, образуя отрицательно заряженные ионы. Такие ионы могут образовывать соли, которые имеют широкое применение в пищевой промышленности, медицине и других отраслях.
Металлы имеют важное значение в химии и играют важную роль в нашем повседневной жизни. Их уникальные свойства и способность образовывать различные химические соединения делают их неотъемлемыми элементами нашего мира.
Роль металлов в химических реакциях

Металлы играют важную роль в химических реакциях благодаря своим уникальным физическим и химическим свойствам. Они способны вступать во множество реакций с другими веществами и демонстрировать различные виды химической активности.
Одной из основных ролей металлов в химических реакциях является их способность образовывать соединения с неметаллами. Эта возможность основана на способности металлов отдавать электроны при взаимодействии с другими веществами. В реакциях с неметаллами такие металлы, как натрий, калий, алюминий и многие другие, образуют ионы соответствующего металла и ионы неметалла. Такие реакции называются реакциями окисления-восстановления.
Металлы также могут быть катализаторами в реакциях. Катализаторы – это вещества, которые ускоряют химическую реакцию, но при этом не участвуют в ее самих процессах. Некоторые металлы, например, платина, железо и никель, обладают каталитической активностью и используются в промышленных процессах для ускорения процессов окисления, гидрирования и других реакций.
Кроме того, металлы могут быть использованы в химических реакциях в качестве электродов. В электрохимических реакциях металлы могут служить положительно заряженными анодами или отрицательно заряженными катодами. Это позволяет использовать их для преобразования энергии, например, в гальванических элементах или аккумуляторах.
Основные классы металлов и их химические свойства

Алкалиновые металлы:
- Натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr) - первая группа периодической системы.
- Они очень реактивны и активно взаимодействуют с водой, образуя гидроксиды щелочей.
- Имеют низкую плотность и температуру плавления, что делает их мягкими и легкими в обработке.
- Обладают низкой электроотрицательностью и высокой электропроводностью.
Щелочноземельные металлы:
- Бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra) - вторая группа периодической системы.
- Они имеют большую плотность и температуру плавления по сравнению с алкалиновыми металлами.
- Химически более реактивны, чем алкалиновые металлы, но менее реактивны, чем алкалиновоземельные металлы.
- Образуют оксиды и гидроксиды, которые являются щелочными веществами.
Переходные металлы:
- Серия элементов от скандия (Sc) до цинка (Zn), а также лантаноиды и актиноиды, являются переходными металлами.
- Они обладают разнообразными химическими свойствами и могут образовывать соединения с различной степенью окисления.
- Характеризуются хорошей проводимостью электричества и тепла, а также высокой твердостью и пластичностью.
- Имеют большую плотность и высокую температуру плавления.
Постпереходные металлы:
- Постпереходные металлы включают группы элементов, расположенные между переходными металлами и металлами-постпереходниками.
- Они обладают разнообразными химическими свойствами и могут образовывать соединения с разными степенями окисления.
- Включают такие элементы, как алюминий (Al), галлий (Ga), индий (In) и олово (Sn).
- Обладают низкой плотностью и температурой плавления, а также хорошей коррозионной стойкостью.
Металлы-постпереходники:
- Металлы-постпереходники - группа элементов, расположенных между постпереходными металлами и неметаллами.
- Они обладают химическими свойствами, которые часто не вписываются в общие законы химии.
- Включают такие элементы, как галлий (Ga), свинец (Pb), бисмут (Bi) и полоний (Po).
- Некоторые из них имеют высокую токсичность и радиоактивность.
Электрохимические свойства металлов
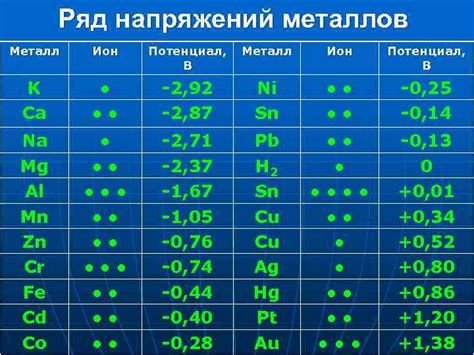
Электрохимические свойства металлов являются одной из важных характеристик, которые определяют их поведение в химических реакциях. Металлы обладают способностью отдавать электроны, что делает их хорошими проводниками электричества и содержит в себе несколько ключевых особенностей.
Во-первых, металлы могут образовывать ионные соединения с неметаллами. В этом случае, металл отдает один или несколько электронов, становясь положительно заряженным ионом, а неметалл получает эти электроны, образуя отрицательно заряженный ион. Таким образом, металл играет роль электронного донора.
Во-вторых, металлы могут участвовать в реакциях окисления и восстановления. Металлы могут быть окислены, т.е. отдать электроны, или же могут быть восстановлены, т.е. принять электроны. Такие процессы позволяют металлам проявлять каталитическую активность и использоваться в электролизе.
Кроме того, металлы обладают свойством быть анодами или катодами в электрохимических реакциях. Анодом является металл, который окисляется и теряет электроны, а катодом – металл, который восстанавливается и принимает электроны. Эта особенность используется, например, для защиты металлических конструкций от коррозии, где один металл выступает в роли анода, а другой – в роли катода.
Следует отметить, что электрохимические свойства металлов определяют их степень активности, т.е. способность быть окисленным или восстановленным. Степень активности металлов можно определить с использованием электродного потенциала или рядов напряжения, где металлы упорядочены по возрастанию или убыванию.
Металлы в органической химии
Металлы играют важную роль в органической химии и находят применение во многих органических реакциях и реагентах. Например, палладий, платина и никель могут использоваться как катализаторы в различных органических превращениях. Их присутствие позволяет ускорить реакцию и облегчить прохождение сложных реакционных шагов.
Один из примеров таких реакций - кросс-связывание С-С, которое часто осуществляется при помощи палладия или других металлов. В результате этой реакции возможно создание более сложных органических соединений, таких как ароматические кольца или полициклические системы.
Металлы также могут быть использованы для введения новых функциональных групп в органическую молекулу. Например, гидрид натрия (NaH) часто применяется для превращения кислотных групп в алкоксидные группы. Такое превращение может быть полезно для синтеза эфиров или других органических соединений с алкоксидной группой.
Некоторые металлы также могут быть использованы в качестве органических реагентов. Например, активные металлы, такие как натрий или магний, могут реагировать с галогенами и реагентами Гриньяра для образования новых органических соединений. Эти реакции часто используются для формирования новых связей C-C и C-X в органических молекулах.
Примеры металлов в различных химических соединениях
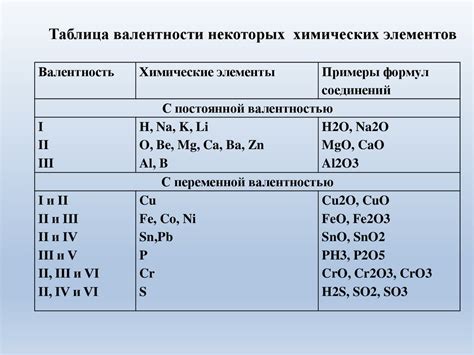
Металлы могут образовывать различные химические соединения, включая соли, окислы, соединения с неметаллами и другие. Некоторые примеры металлов в различных химических соединениях:
- Железо - основной компонент оксидов железа, таких как ржавчина, магнетит и хромите. Также, железо образует множество соединений с различными кислородсодержащими анионами, например, феррицианиды и ферроцианиды.
- Медь - важный компонент различных солей, например, сульфата меди (II) или хлорида меди (II). Кроме того, медь может образовывать соединения с кислородом, например, оксид меди (II) и оксид меди (I).
- Цинк - часто используется в качестве катализатора в органической химии и также может образовывать различные соединения. Например, оксид цинка, карбонат цинка и хлорид цинка.
Также, другие металлы, такие как алюминий, свинец, никель, калий и магний, образуют множество различных соединений с другими элементами, которые имеют широкое применение в различных областях химии.
Металлы и их соединения играют важную роль в химических реакциях и являются основой для множества промышленных и научных процессов. Понимание и изучение этих соединений имеет большое значение для развития новых материалов, разработки новых технологий и оптимизации существующих процессов.
Роль металлов в промышленных процессах

Металлы играют важную роль в различных промышленных процессах, благодаря своим уникальным свойствам и химической активности.
Одна из основных ролей металлов в промышленности - это их использование в процессе производства различных материалов. Например, железо является основным компонентом стали, которая широко применяется в строительстве, машиностроении и других отраслях промышленности. Алюминий, благодаря своей легкости и высокой прочности, используется в производстве авиационных и автомобильных деталей, а также для создания упаковочных материалов.
Металлы также играют важную роль в процессах электропромышленности. Медь, благодаря своей высокой электропроводности, используется для изготовления проводов и кабелей. Алюминий также широко применяется в производстве электротехнических изделий, например, магнитных двигателей.
В промышленных процессах металлы часто используются в качестве катализаторов. Например, платина и родий используются в процессах каталитического конвертирования отработавших газов автомобилей для снижения выбросов вредных веществ. Металлы также играют важную роль в химической промышленности, где они используются для катализа различных химических реакций.
Кроме того, металлы находят применение в промышленных процессах благодаря своей способности проводить тепло и электричество. Они используются в производстве теплопроводящих материалов, например, радиаторов и теплообменников. Также металлы широко применяются в процессах электропроводки и создании электронных устройств.
Вопрос-ответ

Какие металлы являются основными элементами в химических соединениях?
Металлы, такие как железо, медь, алюминий и свинец, часто являются основными элементами в химических соединениях.
Какие связи образуют металлы в химии?
Металлы образуют ионные связи и ковалентные связи в химических соединениях.
