Металлургия - это отрасль промышленности, основной целью которой является получение металлических материалов из руды и их последующая обработка. Химические реакции играют важную роль в металлургических процессах, позволяя превратить руду в полезные металлические сплавы с определенными свойствами.
Одной из наиболее известных химических реакций в металлургии является процесс обогащения руды. Обогащение руды включает несколько этапов, включая дробление руды, ее сортировку и обогащение. В процессе обогащения руды применяются различные химические реакции, такие как флотация, соляная обработка и гидрометаллургия, которые позволяют извлечь ценные металлы из руды.
Еще одной важной химической реакцией в металлургии является процесс экстракции. В процессе экстракции из руды извлекаются ценные металлы с помощью химических реагентов, таких как кислоты или щелочи. Этот процесс позволяет получить чистые металлические элементы, которые могут быть дальше использованы в различных отраслях экономики.
Химические реакции также играют важную роль в процессе производства металлических сплавов. Металлические сплавы получаются путем соединения двух или более металлических элементов при помощи различных химических реакций. Это позволяет создавать сплавы с различными свойствами, такими как прочность, термическая устойчивость и устойчивость к коррозии, что делает их идеальными для использования в различных отраслях промышленности.
Основные химические реакции в металлургии
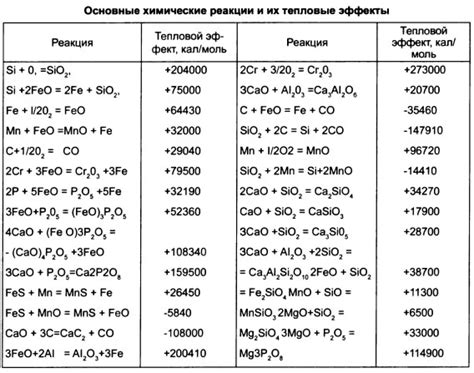
Окислительно-восстановительные реакции - важный класс химических реакций, которые играют ключевую роль в металлургии. В этих реакциях происходит перенос электронов между веществами, что позволяет изменять степень окисления металлов.
Примером окислительно-восстановительных реакций в металлургии является процесс выплавки железной руды. При нагреве смеси железной руды с углеродом, которое называется плавником, происходит реакция, в результате которой железная руда восстанавливается до чистого железа, а углерод окисляется до углекислого газа.
Пример реакции:
- Fe2O3 + 3С → 2Fe + 3СО
Взаимодействие металлов с кислородом - еще одна важная реакция в металлургии. К металлам, таким как железо, алюминий, магний и цинк, относится химически активный кислород атмосферы, что приводит к образованию оксидов металлов.
Примером такой реакции является окисление железа в результате процесса коррозии. При взаимодействии железа с кислородом влажного воздуха образуется ржавчина - оксид железа, которая приводит к разрушению металла.
Пример реакции:
- 4Fe + 3O2 → 2Fe2O3
Реакции с кислотами и щелочами также важны в металлургии. Многие металлы реагируют с кислотами и щелочами, что позволяет их использовать в различных процессах обработки металлов.
Примером такой реакции является взаимодействие алюминия с щелочью. При реакции алюминия с раствором щелочи, например, натрия или калия, образуется соответствующий соль и выделяется водород.
Пример реакции:
- 2Al + 2NaOH + 2H2O → 2NaAl(OH)4 + 3H2
В итоге, знание основных химических реакций в металлургии позволяет контролировать и оптимизировать процессы обработки металлов, что является важным фактором в производстве металлических материалов.
Взаимодействие металлов с кислородом

Взаимодействие металлов с кислородом является одним из основных процессов в металлургии. Кислород может вступать в реакцию с металлами при высоких температурах или под воздействием газообразных окислителей, таких как воздух.
В результате реакции кислорода с металлами образуются оксиды металлов. Оксиды металлов могут иметь различные свойства, в зависимости от соотношения кислорода и металла в соединении. Некоторые оксиды металлов являются кислотными, другие – щелочными, а некоторые – амфотерными.
Взаимодействие металлов с кислородом может приводить к образованию поверхностных слоев металла, состоящих из оксидов. Такие слои, называемые пассивными, могут защищать металл от дальнейшей коррозии и окисления. Некоторые металлы, такие как алюминий и хром, обладают способностью образовывать пассивные слои оксидов, что позволяет им сохранять свои свойства при длительном воздействии окисляющих сред.
Взаимодействие металлов с кислородом также может приводить к образованию оксидных пленок на поверхности металла. Однако, в зависимости от условий реакции, эти пленки могут быть разрушены или иметь низкую прочность. Поэтому в технологических процессах металлургии часто используют специальные методы, такие как обработка специальными оксидирующими средами или применение защитных покрытий, чтобы предотвратить окисление металлов и сохранить их свойства.
Реакции образования солей металлов

В металлургии широко применяются реакции образования солей металлов. Соли металлов образуются в результате взаимодействия металла с кислотой. При этом образуется соль и выделяется водород. Реакции образования солей металлов могут проходить как в растворе, так и в твердом состоянии.
Реакции образования солей металлов имеют свои характерные формулы. Например, реакция образования соли цинка может быть представлена следующей формулой: Zn + 2HCl = ZnCl2 + H2. В данной реакции цинк вступает во взаимодействие с соляной кислотой, при этом образуется хлорид цинка и выделяется молекулярный водород.
Некоторые соли металлов обладают интересными свойствами. Например, соль меди, известная как купрум, имеет синий цвет и широко применяется в химической промышленности. Купрум используется для окрашивания стекла, керамики и текстиля, а также в производстве украшений.
Реакции образования солей металлов являются важным этапом в металлургическом процессе. Они позволяют получать ценные металлы, которые находят широкое применение в различных отраслях промышленности. Знание формул и свойств солей металлов является неотъемлемой частью изучения химических реакций в металлургии.
Реакции окисления и восстановления
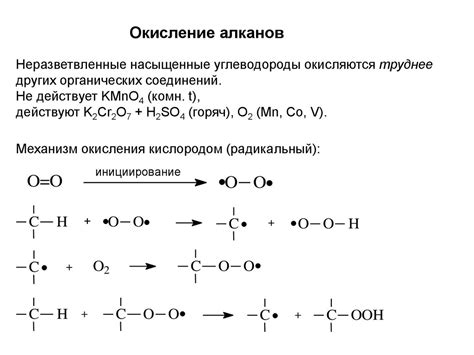
Реакции окисления и восстановления являются важным аспектом металлургического процесса. Окисление - процесс перехода вещества в состояние с более высоким содержанием кислорода. Восстановление, наоборот, представляет собой процесс снижения окислительного состояния вещества.
В металлургии реакции окисления и восстановления играют решающую роль. Они позволяют изменить состояние и свойства металлического материала для получения желаемых характеристик. Например, реакции окисления и восстановления используются для удаления примесей, повышения прочности и твердости металла или изменения его цвета и блеска.
Процесс окисления и восстановления происходит в результате взаимодействия металла с окружающей средой. Металл обладает электрохимической активностью, поэтому может выступать как окислителем, так и восстановителем. Реакции окисления и восстановления могут происходить как при контакте с кислородом, так и с другими веществами.
Реакции окисления и восстановления в металлургии могут быть также использованы для получения новых веществ. Например, при окислении железа получают окись железа, а при его восстановлении – металлическое железо. Эти процессы позволяют производить различные виды металлов и сплавов с заданными свойствами и характеристиками.
Образование сплавов и растворение металлов

Образование сплавов и растворение металлов являются одними из основных процессов в металлургии. Сплавы представляют собой материалы, состоящие из двух или более металлических элементов, которые объединяются в однородную структуру. Растворение металлов, или растворимость, определяет способность металла растворяться в другом металле или сплаве.
Образование сплавов возможно благодаря химическим реакциям между металлами. При взаимодействии двух или более металлов происходит образование нового материала с уникальными свойствами. Эти свойства могут быть изменены изменением состава сплава или процесса его обработки.
Растворение металлов происходит за счет диффузии, когда атомы одного металла перемещаются в структуру другого металла. Растворение может происходить на молекулярном уровне, когда атомы металла размещаются между атомами другого металла, или на микроскопическом уровне, когда металлическая решетка размывается атомами другого металла.
Растворение и образование сплавов имеют важное значение в металлургии. Они позволяют создавать материалы с улучшенными механическими и физическими свойствами, такими как прочность, твердость, стойкость к коррозии и др. Кроме того, сплавы обладают большей пластичностью и легкостью обработки по сравнению с чистыми металлами. Все это делает их востребованными в различных отраслях промышленности, включая авиацию, судостроение, электронику и другие.
Кислотно-щелочные реакции в металлургии
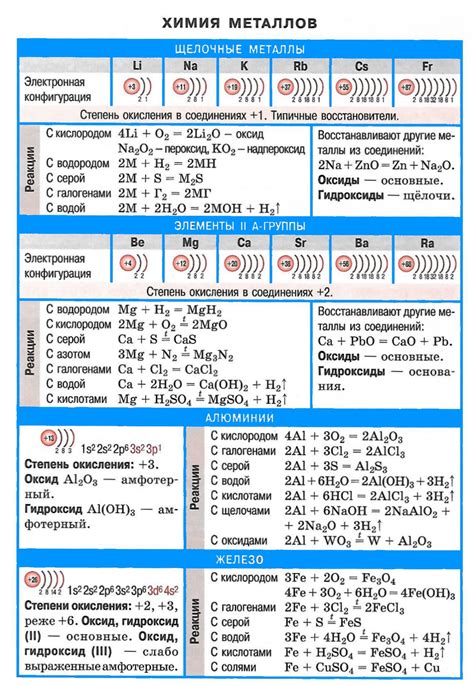
Кислотно-щелочные реакции являются важной составляющей процессов, применяемых в металлургии. Эти реакции позволяют эффективно очищать и обработать металлы, улучшая их качество и свойства.
В металлургии основными кислотами, которые используются в реакциях, являются серная и соляная кислоты, а щелочами - гидроксиды аммония, натрия и калия. Процессы кислотно-щелочной обработки применяются для удаления оксидных пленок, сажи, ржавчины и других загрязнений со слитков и изделий из металлов.
Особенностью кислотно-щелочных реакций в металлургии является их селективность. Это означает, что данные реакции происходят только с определенными веществами, сохраняя другие компоненты металла практически нетронутыми. Это позволяет обрабатывать поверхность металла с минимальным влиянием на его общую структуру и свойства.
Для проведения кислотно-щелочных реакций в металлургии применяются специальные реагенты, которые обладают высокой химической активностью и способностью взаимодействовать с загрязнениями. Эти реагенты обычно добавляют в раствор кислоты или щелочи в определенной концентрации и поддерживают оптимальные условия для реакции, такие как температура и время воздействия.
Кислотно-щелочные реакции в металлургии являются неотъемлемой частью процессов обработки и очистки металлов. Они позволяют улучшить качество и свойства металлических изделий, обеспечивая их долговечность и надежность.
Окислительные реакции в присутствии кислорода

Окислительные реакции при взаимодействии кислорода с металлами являются важным процессом в металлургии. Кислород является сильным окислителем и способен образовывать соединения с большинством металлов.
В результате окислительной реакции металлы переходят в оксиды или другие соединения. Например, при нагревании железа в присутствии кислорода образуется оксид железа(III) Fe2O3, что является активным процессом ржавления.
Окислительные реакции с кислородом в металлургии имеют важное применение и приводят к получению многих полезных продуктов. Например, окисление алюминия в присутствии кислорода позволяет получить окись алюминия Al2O3, которая широко используется в производстве стекла, керамики и других материалов.
Окислительные реакции в металлургии с кислородом происходят под воздействием высоких температур и могут быть проведены различными способами, например, путем нагрева металлической заготовки в воздухе или воспользовавшись специальными реакционными печами.
Реакции образования оксидов металлов
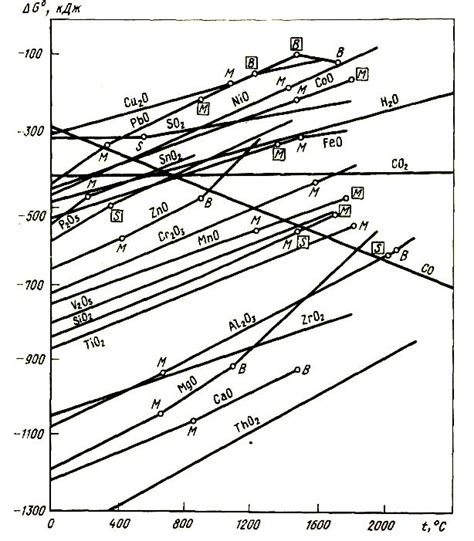
Оксиды металлов - это химические соединения, состоящие из металлического элемента и кислорода. Они играют важную роль в металлургических процессах, таких как производство стали и алюминия.
Одна из самых распространенных реакций образования оксидов металлов - это окисление металла кислородом из воздуха. Например, реакция между железом и кислородом приводит к образованию оксида железа (Fe2+O3). При этом железо теряет электроны и окисляется, а кислород получает электроны и восстанавливается.
В зависимости от условий реакции, оксиды металлов могут иметь различные структуры и свойства. Например, оксид алюминия (Al2O3) может быть как амфотерным (то есть способным реагировать как с кислотами, так и с щелочами), так и нерастворимым в воде.
Реакции образования оксидов металлов могут быть использованы для получения металлов из их руд. Например, для получения цинка из руды используется реакция с кислородом, при которой образуется оксид цинка (ZnO). Затем оксид цинка редуцируется восстановлением с помощью углерода или другого вещества.
Многие оксиды металлов имеют важные промышленные применения. Например, оксид железа (FeO) используется в производстве стали, оксид титана (TiO2) - в производстве красителей и пигментов, а оксид алюминия (Al2O3) - в производстве алюминия и керамики.
Превращения металлов при нагревании

Нагревание металлов может вызвать различные превращения и химические реакции. Одним из наиболее распространенных превращений является окисление металлов, при котором они реагируют с кислородом из воздуха, образуя оксиды.
К примеру, железо при нагревании на воздухе окисляется и превращается в железооксид, известный как ржавчина. Алюминий, в свою очередь, образует оксид алюминия при нагревании, который имеет прочную и стойкую пленку, защищающую металл от повреждений.
В некоторых случаях, при нагревании металлов происходит их взаимодействие с другими веществами, например, с кислотами. Например, цинк реагирует с соляной кислотой, образуя хлорид цинка и выделяя водород. Эта реакция может быть использована для выделения водорода.
Не все превращения металлов при нагревании вызывают разрушение или окисление. Некоторые сплавы могут изменять свои свойства при нагревании. Например, нагревание бронзы, сплава меди и олова, может привести к увеличению твердости и прочности материала.
Вопрос-ответ

Какие химические реакции происходят в металлургии?
В металлургии происходит множество химических реакций. Некоторые из них включают окисление, восстановление, гидролиз, образование сложных соединений и многое другое.
Какие формулы используются для описания химических реакций в металлургии?
Для описания химических реакций в металлургии могут использоваться различные формулы, включая формулы реагентов и продуктов реакции, а также формулы, представляющие изменение состава вещества.
Какими свойствами обладают химические реакции в металлургии?
Химические реакции в металлургии имеют такие свойства, как изменение состава и структуры веществ, энергетические изменения, образование новых веществ и многое другое. Они также могут происходить при высоких температурах и давлениях.
Какие значения имеют химические реакции в металлургии?
Химические реакции в металлургии имеют огромное значение. Они позволяют получать и очищать металлы, изменять их свойства, создавать сплавы, осуществлять превращения одного металла в другой и многое другое. Без химических реакций металлургия не могла бы существовать в современном виде.
