Химические реакции, связанные с взаимодействием металлов с другими веществами, являются важным объектом изучения в химии. Такие реакции позволяют понять основные закономерности и принципы реакций, происходящих с металлами.
Одним из наиболее распространенных типов реакций является окислительно-восстановительная реакция, в которой металлы вступают в реакцию с кислородом или другими окислителями. В результате таких реакций металлы могут окисляться или восстанавливаться в зависимости от своей активности.
Взаимодействие металлов с кислотами также является распространенным типом химических реакций. В этом случае металл реагирует с кислотой, образуя соль и водородный газ. Реакция протекает с образованием большого количества теплоты.
Кроме того, взаимодействие металлов с основаниями приводит к образованию солей и воды. При этом металл замещает водород в молекуле основания, образуя соединение с элементом, занимающим его место в молекуле.
Металлы и их взаимодействие с другими веществами

Металлы - это химический элемент, обладающий специфическими физическими и химическими свойствами, такими как легкоплавкость, хорошая электропроводность и теплопроводность. Это делает металлы важными в производстве множества различных изделий, от строительных материалов до электроники.
Взаимодействие металлов с другими веществами является одной из основных тем в химии. Оно определяет свойства и возможные применения металлов в различных областях. Металлы могут вступать в химические реакции с кислотами, основаниями, солями и другими соединениями, что приводит к образованию новых веществ и изменению свойств исходного металла.
Металлы обладают способностью выделяться при взаимодействии с некоторыми веществами. Например, при контакте с кислородом они могут образовывать оксиды, а с хлором - хлориды. Также, взаимодействуя с различными кислотами (солями), металлы способны образовывать соли. Некоторые металлы могут быть активными и реагировать с водой, образуя соответствующие оксиды и гидроксиды.
Изучение взаимодействия металлов с другими веществами позволяет понять причины возникновения различных химических реакций и основы химической термодинамики. Эта информация важна не только для ученых, но и для промышленных предприятий, которые производят различные изделия из металла и оптимизируют процессы его синтеза и обработки.
Основные принципы химических реакций
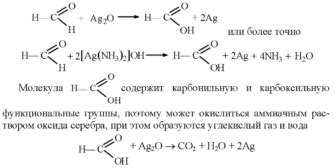
Химические реакции – это процессы, при которых происходит превращение одних веществ в другие. Они основаны на взаимодействии различных химических элементов и соединений.
Главным принципом химических реакций является сохранение вещества. Это значит, что в результате реакции все атомы и ионы, входящие в реагенты, сохраняются в продуктах.
Химические реакции могут проходить под воздействием различных факторов, таких как температура, давление, концентрация реагентов и наличие катализаторов. Эти факторы влияют на скорость реакции и образование желаемых продуктов.
Реакции могут быть обратимыми и необратимыми. В обратимых реакциях можно добиться равновесия между реагентами и продуктами, что позволяет управлять процессом. Необратимые реакции проходят до конца, не образуя равновесия.
В химических реакциях могут происходить различные типы превращений, такие как окисление-восстановление, образование осадков, образование новых соединений и разрушение структуры молекул. Они определяются характером взаимодействия реагентов.
Химические реакции являются основой для понимания и исследования множества природных и технических процессов. Они применяются в различных отраслях, включая медицину, промышленность, пищевую и энергетическую промышленность и др.
Взаимодействие металлов с кислотами

Металлы могут активно взаимодействовать с кислотами, образуя соли и выделяяся газы. Такое взаимодействие основано на реакции обмена, когда ионы металла обмениваются своими позитивными зарядами с ионами водорода из кислоты.
Сильные кислоты, такие как соляная и серная, могут реагировать со многими металлами. Например, разлитая соляная кислота может активно взаимодействовать с алюминием, цинком, железом и другими металлами, выделяя газ водород и образуя соли этих металлов.
Слабые кислоты, такие как уксусная, реагируют с металлами медленнее, но также могут образовывать соли и выделять водородный газ. Например, уксусная кислота может реагировать с медью, образуя соль меди и выделяя пузыри газа.
Некоторые металлы, такие как золото и платина, не реагируют с кислотами и считаются химически инертными к ним. Однако они все равно могут реагировать с кислородом или другими химическими веществами.
Также стоит отметить, что взаимодействие металлов с кислотами может протекать с разной интенсивностью и скоростью в зависимости от концентрации кислоты и поверхностного слоя металла.
Окисление металлов

Окисление металлов — химический процесс взаимодействия металла с кислородом или другими окислителями. В результате окисления вещества происходит образование оксидов металлов. Данный процесс отрицательно влияет на качество металла, так как его поверхность покрывается коркой оксида.
Окисление металлов может протекать при контакте металла с воздухом при нормальных условиях температуры и давления. Особенно подверженны окислению активные металлы, такие как железо, алюминий, медь и др. Окисление металлов может приводить к их коррозии и разрушению.
Окисление металлов часто является широко используемым методом для получения различных веществ. Например, окисление алюминия приводит к образованию оксида алюминия, который используется в производстве керамики, стекла и лакокрасочных материалов. Окисление железа приводит к образованию оксида железа, или ржавчины, которая широко известна в сфере ремесел и строительства.
Реакция металлов с водой

Металлы могут вступать в химическую реакцию с водой, образуя гидроксиды и выделяя водород. Такие реакции называются реакциями металлов с водой. Некоторые металлы, такие как литий, натрий, калий и кальций, очень активно реагируют с водой, образуя соответствующие гидроксиды и выделяя водород в виде газа.
Реакция с водой зависит от активности металла. Например, натрий реагирует с водой очень сильно и быстро, при контакте с водой у него возникает яркая вспышка и появляются пузырьки водорода. Кальций реагирует более медленно, но тоже образует гидроксид и выделяет водород.
Гидроксиды, образованные при реакции металлов с водой, имеют щелочную природу и хорошо растворяются в воде. Эта реакция важна с точки зрения использования металлов в различных областях, таких как производство энергии, промышленность, и др.
Реакция металлов с водой также может быть использована в образовательных целях, чтобы продемонстрировать химические свойства различных металлов и их взаимодействие с другими веществами. Такие эксперименты помогают более глубоко понять принципы химических реакций и свойства веществ.
Взаимодействие металлов с солями

Одним из важных аспектов взаимодействия металлов с другими веществами является их реакция с солями. Соли представляют собой химические соединения, состоящие из металлов и неметаллов. Взаимодействие металлов с солями может происходить по разным путям и зависит от свойств соли и металла.
Одним из распространенных видов реакций является образование осадка, который может быть виден как мутность или выпадение вещества из раствора. Это происходит, когда ион металла вступает в реакцию с соответствующим ионом соли. Например, реакция между медью и серной кислотой приводит к образованию медного сульфата, который является осадком.
Еще один возможный тип реакций - эквивалентный обмен. В этом случае ионы одного металла замещают ионы другого металла в соли. Например, реакция между цинком и серной кислотой приводит к образованию цинкового сульфата и выделению водорода. В таких реакциях важную роль играют электрохимические потенциалы металлов, которые определяют их способность вытеснить друг друга из солей.
Взаимодействие металлов с солями может использоваться в различных сферах нашей жизни. Например, в гальванических элементах происходит реакция металлов с ионами солей, что позволяет получать электрическую энергию. Кроме того, многие из нас знакомы с применением металлов и солей в кулинарии - приготовление пищи в алюминиевой посуде или добавление солей для придания вкуса и аромата блюдам.
Таким образом, взаимодействие металлов с солями представляет собой широкий и разнообразный процесс. Это явление имеет большое практическое значение и находит применение во многих областях научных и промышленных исследований, а также в повседневной жизни.
Металлы и реакции с щелочными растворами

Металлы являются активными элементами, которые могут вступать в реакции с различными веществами. Одним из важных типов реакций металлов являются реакции с щелочными растворами. Щелочные растворы, такие как гидроксиды натрия, калия или гидроксид аммония, обладают щелочной средой с высоким показателем pH.
Когда металлы вступают в контакт с щелочными растворами, происходят реакции окисления и образования гидроксидов металла. Например, активные металлы, такие как натрий или калий, окисляются взаимодействием с гидроксидом натрия или калия и образуют гидроксиды данного металла. Данные реакции протекают с выделением водорода.
Примеры реакций:
- 2Na + 2NaOH → 2Na2O + H2O
- K + KOH → K2O + H2O
Некоторые металлы, такие как цинк или алюминий, способны вступать в реакцию с щелочными растворами и образовывать соответствующие гидроксиды металла и соли. Например, цинк взаимодействует с гидроксидом натрия или калия и образует гидроксид цинка и натриевую или калиевую соль.
Такие реакции с щелочными растворами могут быть использованы для получения различных металлических соединений и солей. Кроме того, реакция металлов с щелочными растворами играет важную роль в процессе нейтрализации и очистки промышленных сточных вод.
Коррозия металлов: причины и способы защиты

Коррозия металлов — это процесс разрушения металлических материалов под воздействием окружающей среды. Главной причиной коррозии является электрохимическое взаимодействие металла с веществами, находящимися в окружающей среде. В результате этого процесса металл постепенно разрушается, что может привести к снижению прочности и ухудшению внешнего вида изделий.
Одной из наиболее распространенных причин коррозии является воздействие влаги. При попадании влаги на поверхность металла происходит окисление, в результате чего на поверхности образуется оксидная пленка, которая постепенно уничтожает металл. Комплексные воздействия атмосферного влажного воздуха, дождя, соляной кислоты и других агрессивных веществ значительно усиливают процесс коррозии.
Существует несколько способов защиты металлов от коррозии. Одним из механических способов является нанесение защитного слоя на поверхность металла. Это может быть покрытие из эмали, краски или гальванического покрытия. Также эффективным способом является использование специальных антикоррозионных масел и смазок, которые создают защитный слой на поверхности металла.
Химическим способом защиты является обработка металла антикоррозионными веществами, такими как растворы антикоррозионных солей или применение растворяемых защитных пленок. Эти вещества обладают свойством образовывать тонкие защитные пленки на поверхности металла, которые препятствуют воздействию окружающей среды на металл. Также применяются методы катодной защиты, при которых создается электрический ток, направленный на защиту металла от коррозии.
Важно отметить, что выбор способа защиты металла от коррозии зависит от условий эксплуатации, типа металла и требуемой степени защиты. Комбинация нескольких способов часто является наиболее эффективным решением. В любом случае, защита металла от коррозии является необходимой мерой, которая позволяет увеличить срок службы металлических изделий и обеспечить их надежность и сохранность.
Вопрос-ответ

Какие металлы могут реагировать с водой?
Некоторые металлы, такие как натрий (Na), калий (K) и кальций (Ca), могут реагировать с водой. При этом образуется щелочь и выделяется водород. Это происходит из-за высокой реакционной способности этих металлов.
Какие металлы могут реагировать с кислотами?
Некоторые металлы, такие как цинк (Zn), алюминий (Al) и железо (Fe), могут реагировать с кислотами. При этом образуется соль металла и выделяется водород. Реакция с кислотами происходит из-за того, что металлы имеют большую электроотрицательность по сравнению с водородом.
Что происходит при реакции металлов с кислородом?
Когда металлы реагируют с кислородом, они образуют оксиды. В этой реакции металл отдает электроны кислороду, образуя положительные ионы. Оксиды металлов часто являются основаниями или щелочами, в зависимости от степени ионизации металлического катиона.
