Взаимодействие металлов с химическими веществами – это процесс, при котором металлы вступают в реакцию с различными химическими соединениями. Это явление имеет большое значение в различных сферах нашей жизни, включая промышленность, науку и быт.
Одним из наиболее распространенных примеров взаимодействия металлов с химическими веществами является окисление железа при воздействии кислорода из воздуха. Благодаря этому процессу образуется ржавчина – характерное красно-бурые отложения на поверхности железа. Это явление хорошо известно каждому, кто когда-либо видел коричневые пятна на поверхности металлических предметов.
Другим примером взаимодействия металлов с химическими веществами является реакция алюминия с кислородом, которая приводит к образованию оксидной оболочки на поверхности металла. Эта оболочка надежно защищает алюминий от дальнейшего окисления и коррозии.
Еще одним интересным примером взаимодействия металлов с химическими реагентами является реакция цинка с серной кислотой. При этой реакции образуется водород, а поверхность цинка становится матовой и получает серый оттенок.
Таким образом, взаимодействие металлов с химическими веществами – это процесс, который происходит постоянно в нашей окружающей среде и оказывает существенное влияние на состояние и свойства металлических материалов.
Металлы и кислоты

Металлы обладают активностью во взаимодействии с кислотами и могут вызывать различные реакции. В зависимости от химических свойств металла и кислоты, могут образовываться соли, газы и водород.
Реакция металлов с кислотами основана на обмене ионами. Металл с меньшей активностью может быть разложен кислотой, образуя соль и выделяя газ. Например, растворение цинка в серной кислоте приводит к образованию сульфата цинка и выделению водорода.
Некоторые металлы, такие как алюминий и цинк, обладают амфотерными свойствами и могут реагировать и с кислотами, и с щелочами. Когда алюминий вступает в реакцию с соляной кислотой, образуется хлорид алюминия и выделяется водород.
Некоторые металлы, например, золото, платина и палладий, практически не реагируют с кислотами и не разлагаются под их действием. Это связано с их высокой химической устойчивостью и инертностью.
В ряде случаев реакции металлов с кислотами могут происходить с выделением тепла и образованием опасных веществ. Например, реакция натрия с соляной кислотой ведет к образованию хлорида натрия и выделению водорода, сопровождаемому высокими температурами и брызгами.
Реакция цинка с соляной кислотой

Реакция цинка с соляной кислотой является примером взаимодействия металла с кислотой. Цинк, являющийся активным металлом, способен отдавать свои электроны в реакции с кислотой. Соляная кислота, в свою очередь, обладает высокой силой воздействия на металлы.
В результате реакции цинка с соляной кислотой образуется хлорид цинка и водород. Водород выделяется в виде газа, а хлорид цинка остаётся в растворе. Реакция протекает с выделением тепла и сопровождается характерным шипящим звуком.
Уравнение реакции можно записать следующим образом:
Zn + 2HCl → ZnCl2 + H2
Цинк в реакции выступает в роли восстановителя, отдающего свои электроны, а водород ионизированный водородный ион (H+) – в роли окислителя, получающего электроны.
Реакция цинка с соляной кислотой относится к экзотермическим реакциям, так как в процессе её протекания происходит выделение тепла. Такая реакция широко применяется в химической лаборатории для выделения водорода и получения хлорида цинка.
Реакция железа с серной кислотой

Реакция железа с серной кислотой – это один из примеров химического взаимодействия металла с кислотой. Железо (Fe) активно взаимодействует с серной кислотой (H2SO4), в результате чего образуется серный газ (SO2) и синеголубое вещество – сульфат железа (FeSO4).
Реакция протекает по следующему химическому уравнению:
Fe + H2SO4 → FeSO4 + H2O + SO2
В данной реакции железо выступает в роли восстановителя, а серная кислота – в роли окислителя. В процессе взаимодействия происходит перенос электронов, приводящий к образованию продуктов реакции. Серный газ, образующийся в результате реакции, является одним из основных побочных продуктов в данном случае.
Реакция железа с серной кислотой может быть полезной в промышленности, например, для получения сульфата железа, который используется в производстве удобрений, керамики и других химических веществ. Кроме того, данная реакция имеет ряд применений в аналитической химии: сульфат железа используется в качестве индикатора при определении сероводорода и других соединений.
Металлы и основания

Основания – это химические вещества, которые могут принимать на себя протоны от других веществ. Для большинства оснований характерен щелочной pH, они испытывают щелочное растворение в воде и образуют гидроксиды металлов.
Металлы с активными катионами образуют гидроксиды, которые, в свою очередь, являются основаниями. Примером такого металла может служить натрий (Na). Когда натрий вступает в контакт с водой, происходит экзотермическая реакция, и образуется гидроксид натрия (NaOH), или щелочь. Гидроксид натрия имеет щелочную природу и является распространенным щелочным раствором.
Другим примером металла, образующего основания, может служить калий (K). Взаимодействие калия с водой также приводит к образованию гидроксида калия (KOH), который является сильным щелочным раствором.
Металлы с активными катионами способны давать основания в реакции с водой или другими веществами. Это вызвано способностью таких металлов получать положительный заряд и, следовательно, принимать на себя протоны от других веществ.
Реакция алюминия с гидроксидом натрия

Реакция алюминия с гидроксидом натрия происходит при взаимодействии этих веществ в водном растворе. Гидроксид натрия, NaOH, является щелочным веществом, а алюминий, Al, является металлом из группы алюминиево-борской подгруппы периодической системы.
Реакция протекает с образованием гидроксида алюминия и соли натрия. При этом происходит обмен ионами: ионы гидроксида натрия (NaOH) перемещаются из раствора на поверхность алюминия, а ионы алюминия (Al) перемещаются из поверхности алюминия в раствор.
Данная реакция характеризуется выделением водорода. В результате обмена ионами и протекания химической реакции возникают бульки газа на поверхности алюминия.
Реакция алюминия с гидроксидом натрия является практически полной, то есть большая часть алюминия вступает в реакцию с гидроксидом натрия. Однако, на поверхности алюминия может сохраняться тонкий слой оксида алюминия, который может предотвращать дальнейшее взаимодействие металла с гидроксидом.
Реакция меди с гидроксидом аммония

Гидроксид аммония (NH4OH) – это амфотерное соединение, способное как вести себя как кислота, так и как щелочь. Реакция меди с гидроксидом аммония является стандартной методикой получения качественных реакций на медь.
При взаимодействии меди с гидроксидом аммония происходит образование сложного ионообменного соединения – гидроксида меди (II). Реакция протекает по следующей схеме:
- Вначале образуется слабый осадок гидроксида меди (II), который можно представить как Cu(OH)2.
- Затем растворимость образовавшегося осадка меняется под воздействием избытка гидроксида аммония – Cu(OH)2 переводится в ионный вид, образуя темно-синий раствор Cu(NH3)42+, содержащий сложные ионы меди с аммиаком.
Таким образом, реакция меди с гидроксидом аммония позволяет получить медный гидроксид (II), который может быть использован в дальнейших химических превращениях или аналитических исследованиях меди и её соединений.
Металлы и оксиды
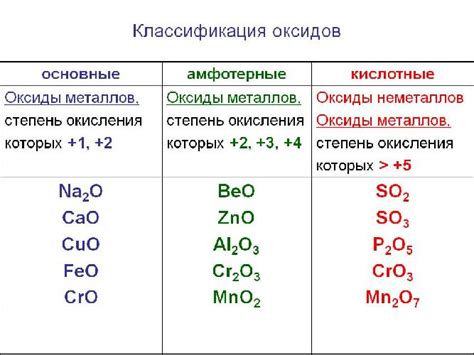
Оксиды металлов - это соединения металлов с кислородом. Они играют важную роль в химических реакциях и имеют различные свойства и применения. К примеру, оксид железа, Fe2O3, химически нейтрален, но обладает высокой коррозионной активностью и используется в процессе ржавления металлов.
Некоторые металлы образуют несколько типов оксидов, в зависимости от степени окисления. К примеру, у железа существует не только Феррооксиды, но и Гидроксиды железа, алюминия, магния и других металлов обладают щелочными свойствами и используются в производстве щелочных батарей и алмазного охлаждения.
Оксиды металлов также могут использоваться в качестве катализаторов в различных химических процессах. Например, оксид цинка, ZnO, используется в качестве катализатора при получении метанола из углекислого газа.
Оксиды металлов могут иметь различные цвета, и этот фактор может использоваться в их декоративных и художественных целях. Например, свинцовый оксид, PbO, используется для придания красного цвета керамике и стеклу.
Вопрос-ответ

Какие металлы реагируют с соляной кислотой?
С некоторыми металлами соляная кислота реагирует с выделением водорода. К таким металлам относятся цинк, железо, алюминий.
Какие примеры взаимодействия металлов с водой можно привести?
С водой реагируют некоторые металлы, например, натрий и калий. При контакте этих металлов с водой начинается интенсивное выделение водорода, а на поверхности металла образуется кислота растворимость.
Какие металлы реагируют с кислородом?
С кислородом реагируют некоторые металлы, такие как железо и алюминий. При окислении этих металлов на их поверхности образуется оксид, который дает характерный цвет и структуру. Например, оксид железа имеет красно-коричневый цвет и называется ржавчиной.
Какие металлы могут реагировать с серной кислотой?
С серной кислотой реагируют некоторые металлы, например, цинк и медь. При этом происходит выделение сульфатов металлов, а также образование воды и диоксида серы.
