Реакция металлов с кислотами и основаниями – одно из основных явлений в химии, которое широко изучается в рамках химического курса. Она представляет собой процесс взаимодействия металла с кислотой или основанием, в результате которого изменяются электронная структура и свойства металла.
Одна из самых распространенных реакций – реакция металлов с кислотами. В процессе такой реакции между металлом и кислотой происходит обмен элементами: металл отдает электроны, образуется ион металла, а из кислоты выделяется водород. У каждого металла может быть своя реакция с кислотой, и она определяется его электрохимическим потенциалом.
Реакция металлов с основаниями имеет свои специфические особенности. Основание – это химическое соединение, которое обладает щелочными свойствами и способно выделять гидроксид ионом. При взаимодействии металла с основанием образуется соль металла и вода. В этом случае также происходит обмен элементами: металл отдает электроны, образуя катион, а основание – принимает электроны, образуя анион гидроксида.
Свойства реакции металлов с кислотами
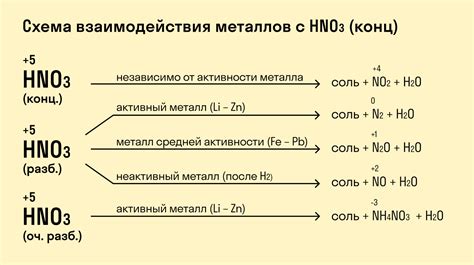
Реакция металлов с кислотами является основным способом получения солей и водорода. Эта реакция обладает несколькими особыми свойствами, которые определяют ее химические и физические процессы.
1. Выделение водорода. Когда металл вступает в реакцию с кислотой, образуется соль и водород. Образование водорода происходит в результате высвобождения ионов водорода из кислоты, которые затем вступают в реакцию с металлическими ионами.
2. Выделение тепла. Реакция металлов с кислотами является экзотермической, то есть выделяется тепло. Это связано с энергетическими изменениями, происходящими в процессе реакции, и является следствием изменения энтальпии системы.
3. Избирательность реакций. Некоторые металлы реагируют с кислотами только при определенных условиях. Например, алюминий реагирует с соляной кислотой только в присутствии хлорида железа. Это объясняется химическими особенностями реагентов и их способностью образовывать сложные соединения.
4. Коррозия и разрушение. Реакция металлов с кислотами может привести к коррозии и разрушению металлических поверхностей. Кислотные реакции могут вызывать растворение и разъедание металла, что приводит к образованию пузырей, облаков пены и образованию пористых структур.
Таким образом, свойства реакции металлов с кислотами определяют характер реакций, их направленность и возможные последствия для металлических материалов. Изучение этих свойств позволяет более глубоко понять и контролировать химические процессы, происходящие в системе металл-кислота.
Степень активности металлов

Металлы различаются по своей активности в реакциях с кислотами и основаниями. Активность металла зависит от его электрохимического потенциала, который определяется его строением и свойствами. Металлы могут быть активными или пассивными в реакциях с кислотами и основаниями.
В таблице активности металлов они располагаются по убыванию их активности. Наиболее активные металлы находятся вверху таблицы, а наименее активные - внизу. Например, литий, натрий и калий относятся к самым активным металлам, поэтому они реагируют с кислотами и основаниями очень быстро.
Металлы средней активности, такие как железо и медь, реагируют не так быстро, как литий и натрий, но все равно способны образовывать соли с кислотами и основаниями. Металлы с низкой активностью, такие как золото и серебро, реагируют очень медленно или не реагируют вообще с кислотами и основаниями.
Степень активности металлов определяет их реакционную способность и способность образовывать соли. Это свойство металлов играет важную роль в различных химических процессах и при решении практических задач в области промышленности и научных исследований.
Образование солей
Интересной особенностью реакции металлов с кислотами и основаниями является образование солей. Соль - это химическое соединение, состоящее из катиона металла и аниона кислоты или основания.
При реакции металла с кислотой образуется соль и выделяется водород, например, медь реагирует с соляной кислотой, образуя соль меди(II) хлорида и выделение водорода. В результате этой реакции образуется хлорид в общей формуле CuCl₂.
При реакции металла с щёлочью происходит образование соли и выделение воды. Например, натрий реагирует с гидроксидом натрия, образуя соль натрия и выделяя воду. Результатом данной реакции является образование гидроксида натрия (NaOH).
Однако не все реакции металлов с кислотами и основаниями приводят к образованию солей. Например, реакция алюминия с серной кислотой приводит к образованию сульфата алюминия и выделению сероводорода. В данном случае мы получаем соль, но она остается растворенной в воде и не образуется кристаллическое вещество.
Характерные особенности реакции

Реакция металлов с кислотами и основаниями имеет ряд характерных особенностей, связанных с их химическими свойствами и реакционной способностью.
- Степень активности металла. Реакция зависит от степени активности металла. Наиболее активные металлы, такие как калий и натрий, образуют сильные основания и реагируют с кислотами с выделением большого количества тепла и выделением газа.
- Скорость реакции. Реакция металлов с кислотами и основаниями происходит с разной скоростью в зависимости от свойств и концентрации реагирующих веществ.
- Тип реакции. Реакция металлов с кислотами и основаниями может быть окислительно-восстановительной, когда металл окисляется, превращаясь в ион, а кислород из кислоты или основания восстанавливается. Также может происходить образование солей и выделение газа.
- Образование соли. При реакции металла с кислотой или основанием образуется соль, которая обладает специфическими свойствами и может использоваться в различных отраслях промышленности и научных исследованиях.
- Образование газа. Одной из характерных особенностей реакции является выделение газа. При взаимодействии металла с кислотой образуется водородный газ, который можно использовать в различных процессах.
Выделение водорода
Выделение водорода является одним из характерных свойств металлов при их реакции с кислотами и основаниями. В результате данной реакции образуется бурный выделение водорода газа.
При взаимодействии металлов с кислотами в аналитической химии используется реакция металла с кислотой, которая приводит к образованию соответствующих солей и выделению водорода. Реакция металлов с кислотами происходит с выделением тепла и водорода.
Водород обладает такими свойствами как легкость, горючесть и химическую активность. Он реагирует со многими веществами, в том числе с кислотами и основаниями. Особенностью реакции металлов с кислотами является то, что выделение водорода происходит именно во время данной реакции.
Выделение водорода можно также наблюдать при взаимодействии металлов с щелочными растворами (основаниями). При этом в растворе образуется гидроксид металла, а избыток щелочи выводится из реакционной смеси в виде осадка или растворяется в воде.
Изменение окраски растворов

Металлы реагируют с кислотами и основаниями, при этом происходят химические превращения и изменяется окраска растворов.
Реакция металлов с кислотами представляет собой обмен протонами между металлом и кислотой. В результате такой реакции окрашенные исходно растворы кислоты могут преобразоваться в безцветные и прозрачные растворы. Например, при реакции цинка с соляной кислотой, исходный раствор кислоты с ярко-желтой окраской превращается в безцветный раствор хлорида цинка. Это происходит из-за того, что происходит образование соли, не имеющей цвета.
Реакция металлов с основаниями также приводит к изменению окраски растворов. При реакции металла с щелочью, исходный раствор основания может преобразоваться в раствор с металлическим оттенком или даже окраситься в интенсивный цвет. Например, реакция алюминия с гидроксидом натрия приводит к образованию раствора синего цвета. Это связано с образованием ионов алюминия в растворе, которые имеют интенсивный цвет.
Свойства реакции металлов с основаниями
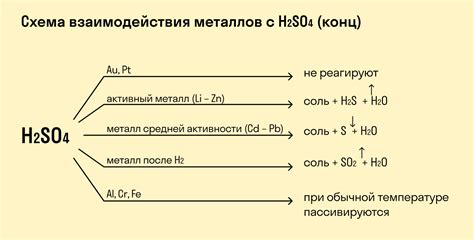
Реакция металлов с основаниями – это взаимодействие металла с раствором или твердым основанием. В результате такой реакции образуются соли и выделяется водород.
Основания, которые реагируют с металлами, включают гидроксиды сильных оснований, таких как гидроксид натрия (NaOH) и гидроксид калия (KOH). Сильные основания обладают высокой основательностью и способны отдавать OH- ионы. Металлы, в свою очередь, способны давать электроны, образуя ионы металла.
Во время реакции с основаниями металлы образуют соединения с отрицательно заряженными OH- ионами. Реакция происходит с выделением водорода, который можно заметить по характерному постуку, пузырькам газа или горению водородной пушки.
Скорость реакции металлов с основаниями зависит от их электрического потенциала. Металлы, имеющие более низкий потенциал, реагируют с основаниями более активно и быстро. К электрохимическим рядам, отражающим активность металлов по отношению к основаниям, следует обращать внимание при проведении экспериментов с реакциями металлов.
Образование гидроксидов
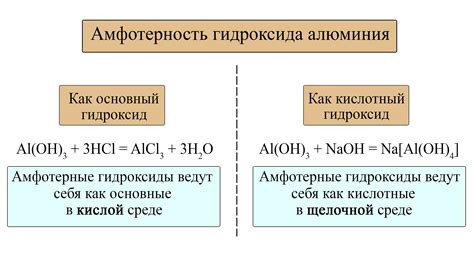
Образование гидроксидов является одним из наиболее характерных свойств металлов при их реакции с кислотами и основаниями. Гидроксиды представляют собой неорганические соединения, состоящие из металла и гидроксильной группы (-OH). Формула гидроксида включает символ металла, за которым следует символ гидроксильной группы.
При реакции металлов с кислотами образуется соль и вода. Металл активно реагирует с кислотой, отдавая электроны и образуя положительный ион. Гидроксид металла образуется только в случае, если кислота содержит в своей формуле атомы кислорода. В таких случаях металл образует гидроксид, осаждая ион гидроксида (-OH) из кислоты в виде растворимой соли.
Реакция образования гидроксидов с основаниями протекает по аналогичному принципу. Однако основания имеют свойство образовывать более стабильные соединения с гидроксидами. Гидроксид металла растворяется в воде, образуя ионы металла (+) и ионы гидроксида (-OH). Гидроксид металла, осажденный из раствора основания, обладает щелочными свойствами и может образовывать щелочные растворы.
В зависимости от химических свойств металлов, образуемые гидроксиды могут иметь различные свойства и степень растворимости в воде. Некоторые металлы, такие как натрий и калий, образуют крайне растворимые гидроксиды, которые легко диссоциируют в воде и образуют щелочные растворы. Другие металлы, например, железо или алюминий, образуют малорастворимые гидроксиды, которые не образуют стабильные щелочные растворы.
Реакция соединений с основаниями

Реакция соединений с основаниями является одним из важных аспектов изучения химических реакций металлов. В химии под основаниями понимаются вещества, обладающие алкалическими свойствами и способные образовывать ионы гидроксида при взаимодействии с водой.
В процессе реакции металлов с основаниями образуются гидроксиды металлов и выделение водорода. Такая реакция протекает с выделением энергии и сопровождается образованием ионов водорода и ионов гидроксида металла. При этом некоторые металлы способны реагировать с гидроксидами с образованием солей и воды.
Реакция металлов с основаниями может протекать самопроизвольно, если металл является активнее основания, и образует анионы с меньшими энергетическими затратами. В то же время, некоторые металлы могут не реагировать с обычными основаниями, но взаимодействуют сильными основаниями, такими как NaOH или KOH.
Реакция металлов с основаниями является важным практическим аспектом в области металлургии и производства различных химических соединений. Изучение свойств и особенностей этой реакции позволяет разрабатывать новые методы синтеза веществ и оптимизировать процессы в производстве.
Вопрос-ответ

Какие металлы реагируют с кислотами и основаниями?
Реагировать с кислотами и основаниями могут различные металлы, включая щелочные и щелочноземельные металлы, а также некоторые переходные металлы. Например, натрий, калий, магний, алюминий и цинк активно реагируют с кислотами, образуя соли и высвобождая водород. Кроме того, эти же металлы могут реагировать с основаниями, образуя гидроксиды металлов и водород.
Что происходит при реакции металлов с кислотами и основаниями?
При реакции металлов с кислотами образуются соли и выделяется водород. Например, реакция натрия с соляной кислотой приводит к образованию хлорида натрия и выделению водорода: Na + HCl → NaCl + H2. При реакции металлов с основаниями образуются гидроксиды металлов и выделяется водород. Например, реакция натрия с гидроксидом калия приводит к образованию гидроксида натрия и выделению водорода: 2Na + 2KOH → 2NaOH + H2.
