Реакция металла с простым газом является одним из важных явлений в химии и материаловедении. Она представляет собой процесс взаимодействия металлического материала с газообразным веществом, которое не обладает сложной структурой или состоит из простых элементов. К таким газам относятся, например, кислород, азот, водород и другие.
В процессе реакции металл может как активно взаимодействовать с простым газом, так и оставаться пассивным. В первом случае металл окисляется или восстанавливается, образуя оксиды или газы. Во втором случае реакция может протекать медленно или вообще не происходить. Это зависит от химической активности металла и условий окружающей среды.
Примерами реакций металла с простыми газами являются окисление железа воздухом, растворение алюминия в кислороде, образование водорода при взаимодействии цинка с соляной кислотой и многие другие. Эти реакции часто применяются в различных областях науки и промышленности.
Свойства простых газов в химических реакциях

Простые газы – это химические элементы, которые находятся в газообразном состоянии при нормальных условиях температуры и давления. Они обладают рядом особых свойств, которые проявляются во время химических реакций.
Простые газы характеризуются высокой реакционной активностью, что означает их способность быстро образовывать химические связи с другими элементами. Они могут проявлять как окислительные, так и восстановительные свойства в химических реакциях.
Некоторые простые газы, такие как кислород и хлор, являются сильными окислителями. Они способны "отнимать" электроны у других элементов, что приводит к образованию окислов. Другие простые газы, такие как водород и углерод, могут быть использованы в качестве восстановителей, то есть они передают свои электроны другим элементам, образуя соединения.
Простые газы могут также образовывать молекулярные соединения с другими элементами при образовании ковалентной связи. Например, кислород может образовывать соединения с азотом, образуя азотную кислоту. Эти соединения обладают своими уникальными свойствами и могут быть использованы в различных областях, включая промышленность и медицину.
При взаимодействии металлов с простыми газами также происходят химические реакции. Например, железо может реагировать с кислородом из воздуха, образуя ржавчину. Эти реакции могут быть важными для понимания процессов коррозии и для защиты металлов от окисления.
Взаимодействие металла с водородом: примеры

Вода́ — это соединение одноатомного металла и кислорода. На основе этого примера можно сказать, что взаимодействие металла с водородом похоже на взаимодействие металла с кислородом. Реакция металлов с водородом часто происходит при высоких температурах и под давлением.
К примерам такого взаимодействия можно отнести взаимодействие щелочных и щелочноземельных металлов (например, натрия и калия) с водородом. При этом реагенты нагреваются до нужной температуры и подвергаются высокому давлению. В результате образуется соединение металла и водорода, которое представляет собой газообразные молекулы H2, заключенные в кристаллическую решетку металла.
Это взаимодействие может происходить и с другими металлами, такими как железо, медь, алюминий и т. д. Однако условия реакции будут различаться в зависимости от свойств и химической активности конкретного металла. Например, для взаимодействия железа с водородом требуется высокая температура и наличие катализатора.
Реакция металла с водородом является важным процессом в различных сферах промышленности. Она может использоваться для получения водорода, водородных топливных элементов и других веществ. Также это взаимодействие является основой для работы водородных аккумуляторов и батарей.
Реакция металла с кислородом: особенности и примеры

Реакция металла с кислородом является одной из наиболее распространенных химических реакций. Эта реакция происходит при взаимодействии металла с окислителем – кислородом. Результатом этой реакции обычно является образование металлического оксида.
Чтобы произошла реакция металла с кислородом, необходимо, чтобы металл был достаточно реакционноспособным и кислород был доступен для реакции. Некоторые металлы, такие как натрий и калий, очень реакционноспособны и реагируют с кислородом уже при обычных условиях.
Примером реакции металла с кислородом является горение магния. При взаимодействии магния с кислородом образуется магниевый оксид. Реакция сопровождается выделением яркого пламени и образованием белого пепла.
Также реакция металла с кислородом может протекать спонтанно в атмосфере при образовании окиси металла. Например, железо со временем окисляется под воздействием кислорода и образует ржавчину.
Исключением в реакции металла с кислородом является реакция некоторых благородных металлов, таких как золото и платина. Эти металлы очень инертны и практически не реагируют с кислородом.
Влияние простых газов на свойства металла

Простые газы, такие как кислород, азот и водород, могут оказывать значительное влияние на свойства металла, включая его прочность, деформацию и химическую активность.
Взаимодействие металла с простыми газами может приводить к окислению металла, что приводит к образованию оксидных пленок на его поверхности. Это может защищать металл от дальнейшего окисления или, наоборот, приводить к его коррозии. Например, железо образует оксид железа (ржавчину) при контакте с кислородом воздуха.
Простые газы также могут влиять на прочность и деформацию металла. Кислород, например, может образовывать в металле оксидные включения, которые снижают его прочность и увеличивают вероятность разрушения при механическом воздействии. Водород, с другой стороны, может проникать в металл и вызывать его хрупкость и склонность к разрушению.
Влияние простых газов на металлы может быть значительным, поэтому важно учитывать их присутствие при проектировании и эксплуатации металлических конструкций. Это может включать применение защитных покрытий, контроль концентрации газов в окружающей среде и регулярное обслуживание и проверку металлических изделий на наличие повреждений и коррозии.
Взаимодействие металла с азотом: примеры и последствия

Взаимодействие металла с азотом – один из типичных примеров химической реакции, проходящей между металлом и простым газом. Азот (N2) является недостаточно активным газом для непосредственного самостоятельного взаимодействия с металлом, однако оно может происходить при повышенных температурах и под действием катализаторов.
Одним из наиболее известных примеров взаимодействия металла с азотом является образование азотида. Например, реакция железа (Fe) с азотом может привести к образованию железного азотида (Fe3N) при высоких температурах. Этот соединение обладает прочными магнитными свойствами и используется в производстве магнитов и магнитных материалов.
Реакция азота с металлами также может приводить к образованию нитрида. Например, реакция алюминия (Al) с азотом может привести к образованию алюминиевого нитрида (AlN). Этот соединение обладает высокой теплопроводностью и используется в электронике, в частности, в производстве полупроводниковых приборов и пластин.
Взаимодействие металла с азотом имеет не только полезные свойства, но и может иметь негативные последствия. Например, при взаимодействии металлических элементов с азотом в атмосфере могут образовываться оксиды азота (NOx), которые в больших количествах являются вредными для окружающей среды и могут вызывать загрязнение атмосферы и проблемы с здоровьем.
Оксидация металла в присутствии газов: реакции и характеристики
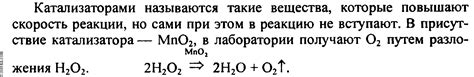
Оксидация металла – это процесс химической реакции, при которой металл взаимодействует с газом и образуются химические соединения – оксиды металлов. Такие реакции часто происходят при воздействии кислорода, водорода и других простых газов на металлы.
Газы могут окислять металлы как при нормальных условиях, так и при повышенной температуре или давлении. Оксидация металла приводит к образованию оксидного слоя на поверхности металла, который может быть защитным или коррозионно-активным.
Примером окисления металла в присутствии газа является реакция железа с водородом. При нагревании металлического железа в водородной среде происходит реакция Fe + H2 -> FeH2, в результате которой образуется гидрид железа.
Другим примером является оксидация металлов кислородом. Например, при воздействии кислорода на алюминий происходит реакция Al + O2 -> Al2O3, образуется алюминиевый оксид. Эта реакция является эндотермической и сопровождается выделением тепла.
Оксидация металла в присутствии газов имеет важное значение в промышленности и науке. Эти реакции используются для производства материалов, покрытий и сплавов с желаемыми свойствами. Кроме того, они помогают понять и объяснить поведение металлов в различных средах.
Зависимость скорости реакции металла с простым газом от условий
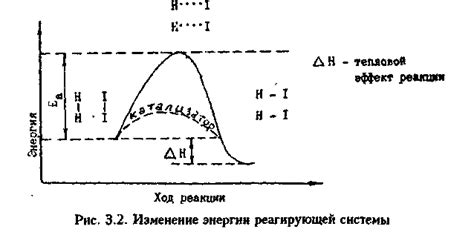
Скорость реакции металла с простым газом зависит от ряда факторов и условий. Одним из наиболее важных факторов является концентрация простого газа. При повышении концентрации газа скорость реакции обычно увеличивается, так как больше молекул газа сталкиваются с поверхностью металла, что способствует частоте реакций и ускоряет процесс.
Температура также оказывает существенное влияние на скорость реакции металла с простым газом. Повышение температуры увеличивает скорость движения молекул и их энергию, что способствует частым и успешным столкновениям с поверхностью металла. Однако при очень высоких температурах некоторые реакции могут замедляться или прекращаться из-за изменений в структуре и свойствах металла.
Поверхность металла также играет важную роль в реакции с простыми газами. Большая поверхность металла, например, в виде пористых материалов или катализаторов, способствует ускорению реакции, так как обеспечивает большую площадь для столкновений и взаимодействия молекул с газом.
Влияние давления на скорость реакции металла с простым газом часто проявляется в обратной зависимости. Наиболее ярко это проявляется при реакциях, которые идут по механизму сорбции газа на поверхности металла. Увеличение давления газа обычно приводит к увеличению молекулярной площади на поверхности металла, что ведет к ускорению реакции.
Таким образом, скорость реакции металла с простым газом зависит от концентрации газа, температуры, поверхности металла и давления. Понимание этих зависимостей позволяет более эффективно контролировать и ускорять реакции, что имеет важное применение в различных отраслях промышленности и научных исследованиях.
Вопрос-ответ

Какие реакции металлов с простыми газами существуют?
Реакции металлов с простыми газами могут быть различными, но наиболее распространенными являются реакции с кислородом, водородом и азотом.
Какие металлы реагируют с кислородом?
Некоторые металлы, такие как железо, алюминий и магний, реагируют с кислородом, образуя соответствующие оксиды. Например, железо реагирует с кислородом и образует ржавчину.
Какие металлы реагируют с водородом?
Металлы такие, как натрий, калий и магний, реагируют с водородом, образуя соответствующие гидриды. Например, натрий реагирует с водородом и образует гидрид натрия.
