Металлы, входящие в состав периодической системы элементов, обладают способностью вступать в химические реакции с различными веществами. Однако, в строго определенных условиях, некоторые металлы не образуют химических соединений с кислотными оксидами, которые могут входить в состав кислот, оснований и солей. Механизм этого отсутствия взаимодействия связан с электрохимическими свойствами металлов и их способностью к окислительному или восстановительному действию.
Кислотные оксиды, такие как оксид серы (IV), оксид азота (V), оксид фосфора (V) и другие, обладают кислотными свойствами и способностью образовывать кислоты при растворении в воде. В то время как некоторые металлы, такие как цинк, железо, алюминий, образуют стабильные оксиды, которые не реагируют с данными кислотными оксидами. Это обусловлено фактом того, что эти металлы имеют низкое стандартное электродное потенциал, что делает их стабильными в отношении окисления или восстановления в данный момент.
Кроме того, взаимодействие металлов с кислотными оксидами может быть препятствовано наличием защитной пленки оксида, которая формируется на поверхности металла в результате окисления воздухом. Такая пленка может служить барьером для контакта металла с кислотными оксидами, что приводит к отсутствию реакции.
Металлы и кислотные оксиды
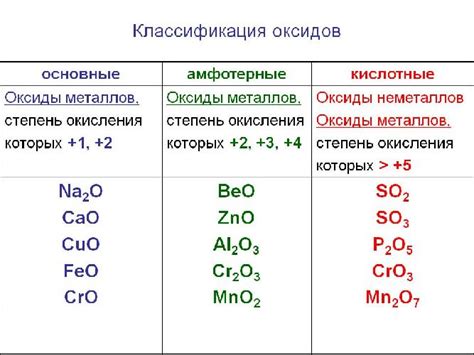
Металлы и кислотные оксиды взаимодействуют между собой и образуют соли. Кислотные оксиды представляют собой оксиды неметаллов, которые взаимодействуют с водой и образуют кислоты. При контакте металлов с кислотными оксидами не происходит непосредственной реакции.
Это связано с тем, что металлы вступают в реакцию с кислотами, образуя соли и выделяя водород. Металлы могут реагировать как с кислотами, содержащими кислотные оксиды, так и с кислотами, не содержащими оксиды.
Реакции металлов с кислотами являются важным аспектом в химической промышленности. Многие из этих реакций используются для получения солей, которые имеют широкое применение в различных отраслях промышленности и в быту. Важно отметить, что реакция металлов с кислотами происходит не только с кислотными оксидами, но и с другими компонентами кислот.
Таким образом, взаимодействие металлов с кислотами и кислотными оксидами является важным химическим процессом, который позволяет получать различные соли, имеющие широкое применение в различных сферах деятельности человека.
Взаимодействие металлов с кислотными оксидами

Кислотные оксиды представляют собой химические соединения, которые образуются при соединении металлов с кислородом. Интересной особенностью этих соединений является отсутствие взаимодействия металлов с ними в составе кислоты, основания и соли. Такое поведение объясняется присутствием ковалентной связи в кислотных оксидах, которая не позволяет металлам образовывать ионные связи.
Ковалентная связь в кислотных оксидах обусловлена наличием между атомами кислорода и металлов общих электронных пар. Именно эта связь обеспечивает стабильность оксида и препятствует взаимодействию металла с другими компонентами состава. Таким образом, металлы не могут реагировать непосредственно с кислотными оксидами и не образуют ионов металла в растворе кислоты.
Однако, кислотные оксиды могут использоваться в качестве катализаторов для реакций с участием металлов. Например, некоторые кислотные оксиды могут активировать металлические поверхности и способствовать реакциям окисления или восстановления металлов. Такие реакции происходят на поверхности оксида и не приводят к образованию ионных соединений.
В заключение, отсутствие взаимодействия металлов с кислотными оксидами обусловлено наличием ковалентной связи в этих соединениях. Однако, эти оксиды могут играть роль катализаторов для реакций металлов, не образуя с ними ионных связей.
Металлы и их оксиды как кислотные оксиды

Оксиды металлов являются одними из важнейших кислотных оксидов. Они обладают кислотными свойствами и способны взаимодействовать с основаниями, образуя соли. Взаимодействие металлических оксидов с водой приводит к образованию кислот, что подтверждает их кислотный характер.
Металлы и их оксиды образуют множество основных соединений, которые широко используются в промышленности, науке и повседневной жизни. Многие металлические оксиды имеют высокую теплостойкость, что делает их незаменимыми материалами в производстве керамики, стекла и различных термостойких материалов.
Оксиды некоторых металлов, таких как алюминий и титан, обладают высокой кислотностью и могут реагировать с щелочами, образуя соли. Это свойство позволяет использовать эти соединения в процессе синтеза различных органических и неорганических соединений.
Интересным фактом является то, что некоторые металлические оксиды имеют как кислотные, так и основные свойства. Например, оксиды алюминия и железа могут взаимодействовать как сильные кислоты и сильные основания, что определяет их универсальность и широкое применение в разных отраслях науки и техники.
Таким образом, металлы и их оксиды являются важными компонентами кислотных соединений, солей и оснований. Их кислотные свойства определяют их активность и способность к химическим реакциям, что делает их важными объектами исследований и применения.
Свойства кислотных оксидов
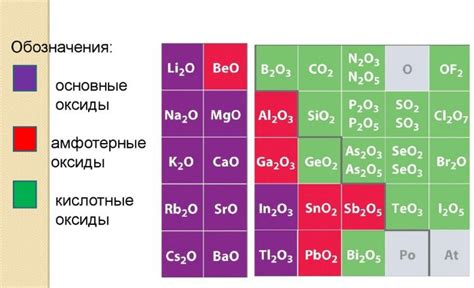
Кислотные оксиды - это неорганические вещества, которые образуют кислоты в реакции с водой. У них есть ряд характерных свойств, которые позволяют их идентифицировать и использовать в различных процессах.
Во-первых, кислотные оксиды хорошо растворяются в воде, образуя кислоты. Это происходит благодаря реакции оксида с водой, в результате которой образуются ионы водорода. Например, оксид серы (IV) реагирует с водой, образуя серную кислоту:
SO2 + H2O → H2SO4
Во-вторых, кислотные оксиды обладают кислотными свойствами. Они реагируют с основаниями, образуя соли и воду. Например, оксид серы (IV) реагирует с гидроксидом натрия, образуя натриевую соль и воду:
SO2 + 2NaOH → Na2SO4 + H2O
В-третьих, кислотные оксиды обладают окислительными свойствами. Они могут переносить кислородные или электронные разности в окислительно-восстановительных реакциях. Например, оксид азота (V) может окислять сернистый ангидрид до серной кислоты:
NO2 + SO2 → NO + SO3
Таким образом, кислотные оксиды обладают рядом характерных свойств, которые определяют их роль в химических реакциях и их применение в различных отраслях науки и промышленности.
Металлы в составе кислоты, основания и соли

Металлы играют важную роль в химических соединениях, таких как кислоты, основания и соли. Они могут действовать как катионы, негативно заряженные ионы или нейтральные атомы в составе этих соединений.
Металлы, действуя как катионы, образуют соли с отрицательно заряженными анионами. Например, медь может образовывать соль с хлоридными ионы (CuCl2). Эти соли могут иметь различные свойства и применения, так как металлы могут влиять на химические и физические свойства соединений.
Металлы также могут быть частью кислотных соединений, где они образуют положительно заряженные катионы. Например, железо может образовывать катионы в составе кислоты серной (FeSO4). Кислоты с металлическими катионами могут иметь различные свойства и реактивность, обусловленные именно металлической частью молекулы.
Кроме того, металлы могут присутствовать в составе оснований, где они играют роль отрицательно заряженных анионов или нейтральных атомов. Например, гидроксид натрия содержит натрий, который действует как катион, и гидроксид, который действует как анион (NaOH). Именно металлическая часть определяет основность молекулы и ее реактивность.
В заключение, металлы являются неотъемлемой частью кислот, оснований и солей. Они вносят свою специфическую химическую природу и свойства в эти соединения, определяя их реакционную способность и физические характеристики.
Отсутствие взаимодействия металлов с кислотным оксидом в составе кислоты
В химических реакциях металлов с кислотами, одним из ключевых факторов, определяющих возможность и интенсивность взаимодействия, является наличие или отсутствие кислотного оксида в составе кислоты. Кислотный оксид играет роль возможного окислителя металла в реакции, а также оказывает влияние на реакционную способность кислоты и ее активность.
Однако существуют случаи, когда металлы не проявляют реактивности и не взаимодействуют с кислотами, содержащими кислотные оксиды. Это связано с двумя основными причинами.
- Стабильность окислителя: Некоторые кислотные оксиды являются стабильными соединениями и не обладают достаточной активностью для окисления металла. В этом случае металл не может участвовать в реакции с кислотой и не проявляет химическую активность.
- Функциональность оксида: Другим фактором, определяющим отсутствие взаимодействия металла с кислотой при наличии кислотного оксида, является его функциональность. В некоторых случаях кислотный оксид может не обладать способностью к окислению металла или не взаимодействовать с ним по другим причинам.
Взаимодействие металлов с кислотами - это сложный процесс, который зависит от множества факторов, включая состав кислоты и наличие кислотных оксидов. Интересно, что взаимодействие одного и того же металла с разными кислотами может происходить по-разному, в зависимости от состава кислоты и ее активности. Поэтому изучение химических свойств металлов и их взаимодействие с кислотами представляет большой интерес для химиков и научного сообщества в целом.
Отсутствие взаимодействия металлов с кислотным оксидом в составе основания
Металлы из группы щелочных металлов и щелочноземельных металлов обладают основными свойствами и реагируют с кислотами, образуя соли и выделяя водород. Однако, в отличие от кислот, металлы не проявляют реактивность при взаимодействии с кислотными оксидами, которые входят в состав многих оснований.
Кислотные оксиды являются соединениями элементов из группы неметаллов с кислородом, и обладают кислотными свойствами. Они реагируют с водой, образуя кислоты и выделяя тепло. Однако, когда кислотные оксиды входят в состав оснований, металлы не проявляют реактивность и не вступают во взаимодействие с этими соединениями.
Отсутствие взаимодействия металлов с кислотными оксидами в составе основания можно объяснить различием в ионно-радиевых свойствах металла и кислотного оксида. Большинство металлов образуют положительные ионы, которые электростатически притягиваются к отрицательно заряженным ионам оксида, но не проявляют активность в реакции.
- Например, кислотный оксид серы SO2 входит в состав оснований, таких как серны оксиды металлов SO. Серные оксиды металлов образуются при взаимодействии серы с активными металлами, и они не реагируют с кислотным оксидом серы.
- То же самое можно сказать и о кислотном оксиде азота NO, который не реагирует с азотистыми оксидами металлов, такими как оксид азота N2O.
- Аналогично, кислотный оксид фосфора P2O5 также не проявляет реактивность при взаимодействии с фосфорными оксидами металлов.
Таким образом, металлы не взаимодействуют с кислотными оксидами, когда те находятся в составе оснований. Это свойство объясняется ионно-радиевыми свойствами металлов и кислотных оксидов, и обусловлено электростатическим взаимодействием разноименно заряженных ионов.
Отсутствие взаимодействия металлов с кислотным оксидом в составе соли

Кислотные оксиды - это соединения, которые образуются в результате сочетания кислорода с неметаллами. Один из примеров таких оксидов - оксид серы (SO2), который представляет собой смесь серы и кислорода. При взаимодействии кислотных оксидов с водой образуются кислоты. Однако при взаимодействии металлов с кислотными оксидами наблюдается отсутствие реакции.
Такая особенность обуславливается условиями реакции и химической природой металлов. Металлы обладают большей активностью по сравнению с ограниченной активностью кислотных оксидов. В химических реакциях металлы готовы уступить свои электроны и образовать положительные ионы, что имеет место при реакциях с кислотами или водой. Однако металлы не обладают такой активностью в отношении кислотных оксидов, поэтому взаимодействия между ними не происходит.
Кроме того, стабильность кислотных оксидов и их низкая электроотрицательность также препятствуют взаимодействию с металлами. Кислотные оксиды имеют большую склонность образовывать ковалентные связи соединений, а не ионные, что затрудняет возможность образования солей с металлами. Эта химическая особенность обусловлена строением и электронной структурой кислорода и сопутствующих компонентов.
Таким образом, взаимодействие металлов с кислотными оксидами в составе соли практически отсутствует из-за различий в активности, стабильности и электрохимических свойствах данных веществ.
Вопрос-ответ

Почему металлы не взаимодействуют с кислотными оксидами в составе кислоты?
Металлы не взаимодействуют с кислотными оксидами в составе кислоты, потому что они обладают высокой электроотрицательностью. Когда металл контактирует с кислотным оксидом, электроотрицательные атомы металла отталкиваются от электроотрицательных атомов оксида и не участвуют в химической реакции.
Что происходит при взаимодействии металлов с основаниями, содержащими кислотный оксид?
При взаимодействии металлов с основаниями, содержащими кислотный оксид, происходит образование солей. Металл обладает высокой электропроводностью, поэтому он способен передавать электроны оксиду, что приводит к образованию ионов в растворе. Эти ионы, в свою очередь, соединяются с ионами кислотного оксида, образуя соль.
Как связано отсутствие взаимодействия металлов с кислотными оксидами и образование солей?
Отсутствие взаимодействия металлов с кислотными оксидами определяет образование солей при их взаимодействии с основаниями, содержащими кислотный оксид. Если металлы взаимодействовали бы с кислотными оксидами напрямую, то они не могли бы образовывать соли с основаниями. Поэтому, отсутствие взаимодействия металлов с кислотными оксидами является важным фактором в образовании солей.
