Реактивность металлов играет важную роль в химических процессах, особенно во взаимодействии с простыми веществами, такими как неметаллы. Эти реакции являются основой многих применений металлов в различных отраслях промышленности и науки.
При взаимодействии с неметаллами, металлы могут проявлять различные степени реактивности. Некоторые металлы, такие как литий и натрий, очень активно реагируют с неметаллами, например, с кислородом. В результате таких реакций могут образовываться оксиды металлов, которые могут использоваться в качестве материалов для производства различных продуктов, таких как керамика или стекло.
Другие металлы, такие как железо и алюминий, также реагируют с кислородом, но их реакция не столь интенсивна, и образование оксидов протекает медленнее. Эти металлы обладают более высокой устойчивостью к окислению и часто используются в производстве различных конструкционных материалов.
Еще одной важной реакцией является взаимодействие металлов с неметаллом хлором. Многие металлы, включая медь, цинк и железо, реагируют с хлором, образуя хлориды металлов. Эти соединения широко используются в сфере химической промышленности, например, как сырье для производства различных кислот и солей.
Реактивность металлов во взаимодействии с простыми веществами предлагает широкий спектр возможностей для использования металлов в различных областях. Понимание химических свойств металлов и их взаимодействия с неметаллами является важным аспектом современной химии, открывающим новые пути для создания новых материалов и технологий.
Физические свойства металлов
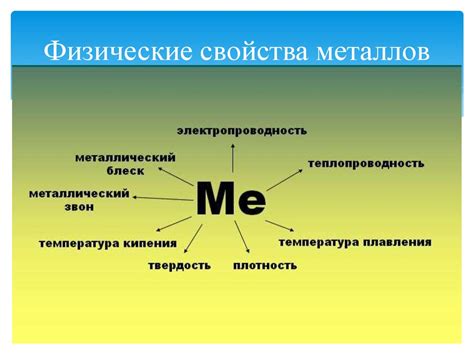
1. Проводимость: Металлы обладают высокой электропроводностью. Это связано с наличием свободных электронов в их валентной зоне. В результате электрический ток может легко протекать через металлическую структуру.
2. Теплопроводность: Металлы также характеризуются высокой теплопроводностью. Благодаря свободным электронам, тепловая энергия передается быстро и эффективно через металлическую сеть.
3. Пластичность и деформируемость: Металлы обладают способностью к пластическим и деформационным изменениям. Они могут легко поддаваться обработке и формированию без того, чтобы ломаться или разрушаться.
4. Массивность и твердость: Одним из основных свойств металлов является их массивность и твердость. Они характеризуются высокой плотностью и устойчивостью к внешним воздействиям.
5. Блеск и металлический цвет: Металлы имеют характерный блеск и металлический цвет, который обусловлен их особыми оптическими свойствами.
6. Высокая плавкость и кипение: Многие металлы обладают высокой плавкостью и кипением, что позволяет использовать их в различных процессах, связанных с нагреванием и плавлением.
7. Малая газовоздухопроницаемость: Металлы обладают низкой проницаемостью для газов и воздуха, что делает их применение в различных областях, где требуется герметичность и непроницаемость.
8. Магнитные свойства: Некоторые металлы обладают магнитными свойствами. Это связано с наличием магнитных моментов в их электронной структуре.
Реактивность металлов и их положение в ряду активности

Реактивность металлов является свойством, определяющим их способность взаимодействовать с другими веществами. Положение металлов в ряду активности зависит от их готовности отдавать или принимать электроны при химических реакциях.
Первые металлы в ряду активности, такие как литий и натрий, относятся к самым реактивным. Они легко реагируют с водой, кислородом и кислотами, образуя соответствующие соединения.
Золото, платина и другие драгоценные металлы находятся в конце ряда активности и считаются малореактивными. Они обладают высокой устойчивостью к окислению и не реагируют с большинством простых веществ.
Промежуточные металлы, такие как железо, медь и цинк, имеют разную степень реактивности. Они способны образовывать различные соединения с несколькими веществами, однако их реактивность не так высока, как у первых металлов в ряду активности.
Знание положения металлов в ряду активности позволяет предсказывать и объяснять их способность к реакциям с другими веществами. Оно также является основой для определения возможности и направления различных химических процессов, связанных с металлами.
Уравнение реакции металла с неметаллом
При взаимодействии металла с неметаллом может происходить химическая реакция, образующая соединение металла с неметаллом. Такие реакции могут быть очень разнообразными и зависят от свойств используемых веществ.
Уравнение реакции металла с неметаллом позволяет описать состав и структуру образовавшегося соединения. В химическом уравнении указываются исходные вещества, их степени окисления, а также продукты реакции.
Например, при взаимодействии алюминия с кислородом образуется оксид алюминия. Корректное уравнение этой реакции выглядит следующим образом:
4Al + 3O2 → 2Al2O3
В данном случае, алюминий и кислород вступают в реакцию в определенных пропорциях, что позволяет получить оксид алюминия. Уравнение указывает на то, что между алюминием и кислородом происходит химическое взаимодействие, при котором образуется оксид алюминия.
Уравнение реакции металла с неметаллом является важным инструментом для понимания химических процессов и прогнозирования их результатов. Оно позволяет определить, сколько исходных веществ будет участвовать в реакции, а также какие продукты образуются. Это позволяет ученым и химикам разрабатывать новые материалы и прогнозировать их свойства.
Общая характеристика свойств металлов в соединениях с неметаллами

Соединения металлов с неметаллами обладают рядом особенных свойств, которые обусловлены химической природой металлов и неметаллов, а также типом взаимодействия между ними.
Во-первых, металлы обладают высокой электроотрицательностью, что делает их способными отдавать электроны и образовывать положительные ионы. Во взаимодействии с неметаллами эти ионы образуют ионные соединения, обладающие кристаллической структурой, высокой твердостью и хорошей электропроводностью.
Во-вторых, металлы могут образовывать соединения с неметаллами, обладающие координатной (или комплексной) структурой. В таких соединениях металлический ион образует комплекс с неметаллом, при этом неметалл встраивается в кристаллическую решетку металла и образует ковалентные связи с его атомами.
В-третьих, соединения металлов с неметаллами характеризуются высокой реакционной способностью. Металлы способны вступать в химические реакции с неметаллами, образуя новые соединения. Эти реакции могут быть экзотермическими и могут сопровождаться выделением тепла и света.
Наконец, соединения металлов с неметаллами имеют разнообразные физические свойства. Некоторые из них обладают металлическими свойствами, такими как тепло- и электропроводность, блеск и пластичность. Другие соединения могут быть не проводниками тока и тепла, иметь низкую твердость и быть хрупкими.
Таким образом, свойства металлов в соединениях с неметаллами определяются их электроотрицательностью, способностью образовывать ионные и координатные соединения, реакционной способностью и физическими характеристиками.
Примеры реакций металлов с неметаллами

Металлы реагируют с неметаллами, образуя различные соединения. Такие реакции могут происходить с газами, жидкостями или твердыми веществами, их результатом являются новые химические вещества с различными свойствами.
Одним из часто встречающихся примеров реакций металлов с неметаллами является реакция металла с кислородом. Так, например, металл натрий при взаимодействии с кислородом образует оксид натрия:
4Na + O2 → 2Na2O
Также встречаются реакции металлов с халогенами, например, реакция калия с бромом:
2K + Br2 → 2KBr
Интересными примерами реакций металлов с неметаллами являются реакции алюминия с кислородом и серой. При взаимодействии алюминия с кислородом образуется оксид алюминия:
4Al + 3O2 → 2Al2O3
А в результате реакции алюминия с серой образуется сульфид алюминия:
2Al + 3S → Al2S3
Кроме того, реакции металлов с неметаллами могут происходить с водородом. Например, реакция магния с водородом приводит к образованию гидрида магния:
Mg + H2 → MgH2
Таким образом, реакции металлов с неметаллами представляют собой важные химические процессы, которые приводят к образованию новых соединений и являются основой для многих промышленных и научных исследований.
Взаимодействие щелочных металлов с неметаллами

Щелочные металлы (такие как литий, натрий, калий) проявляют высокую реактивность во взаимодействии с неметаллами. Их активность обусловлена низкими энергиями ионизации и электроотрицательностями.
Взаимодействие щелочных металлов с неметаллами приводит к образованию различных соединений, таких как соли и оксиды.
Например, реакция натрия с кислородом приводит к образованию оксида натрия, или щелочной золы. Это основной компонент натронной соды, которая широко используется в промышленности и быту.
Другим примером является реакция калия с хлором, в результате которой образуется хлорид калия. Это соль, используемая в пищевой промышленности как приправа, а также в медицине и химической промышленности.
Также, щелочные металлы могут вступать в реакцию с некоторыми неметаллическими галогенами, такими как фтор и бром. Реакция лития с фтором приводит к образованию фторида лития, который используется в очистке металлов и производстве специальных стекол.
Взаимодействие щелочных металлов с неметаллами продемонстрировано довольно широким спектром реакций, приводящих к образованию различных соединений. Эти реакции играют важную роль в химии и имеют практическое применение в различных отраслях промышленности.
Взаимодействие щелочноземельных металлов с неметаллами

Щелочноземельные металлы, такие как магний, кальций, стронций, барий и радий, проявляют характерные свойства при взаимодействии с неметаллами. Одним из наиболее известных примеров является взаимодействие магния с кислородом, при котором образуется оксид магния (MgO).
Взаимодействие магния с хлором приводит к образованию хлорида магния (MgCl2). Это соединение широко используется в медицине и пищевой промышленности.
Кальций обладает более активной реакцией с кислородом, поэтому взаимодействие между этими элементами происходит с выделением большего количества тепла и света. Результатом этой реакции является образование оксида кальция (CaO).
Стронций и барий также проявляют подобные свойства при взаимодействии с кислородом и хлором. Оксид стронция (SrO) и оксид бария (BaO) обладают специфическими свойствами и находят свое применение в различных сферах промышленности.
Радий - самый реактивный из щелочноземельных металлов и образует оксид радия (RaO), который является радиоактивным и имеет очень ограниченное применение. Взаимодействие радия с другими неметаллами широко изучается в рамках ядерной физики.
Взаимодействие переходных металлов с неметаллами

Переходные металлы обладают способностью вступать во взаимодействие с неметаллами, создавая различные химические соединения. Это связано с их особым строением и электронной конфигурацией, позволяющей им формировать разнообразные связи с другими элементами.
Один из самых известных примеров взаимодействия переходных металлов с неметаллами - образование сольных соединений. Соль - это химическое соединение, в котором положительно заряженные ионы металла связаны с отрицательно заряженными ионами неметалла. Например, хлорид меди (II), CuCl2, образуется в результате реакции меди с хлором.
Переходные металлы также могут вступать во взаимодействие с неметаллами, образуя ковалентные связи. Ковалентная связь - это связь, в которой электроны общих поперечных орбиталей переходного металла и неметалла образуют общие электронные пары. Пример такого взаимодействия - образование комплексов переходных металлов с аммиаком. Аммиак (NH3) является неметаллом и может образовать ковалентную связь с ионами переходных металлов.
Другими примерами взаимодействия переходных металлов с неметаллами являются образование окислов и гидридов. Окислы - соединения, в которых переходный металл связан с кислородом, а гидриды - соединения, в которых переходный металл связан с водородом.
Таким образом, взаимодействие переходных металлов с неметаллами происходит путем образования сольных соединений, ковалентных связей, окислов и гидридов. Это позволяет переходным металлам вступать во взаимодействие с различными элементами и образовывать разнообразные химические соединения.
Вопрос-ответ

Какие реактивные металлы могут образовывать соединения с неметаллами?
Реактивные металлы, такие как натрий, калий, магний и алюминий, могут образовывать соединения с неметаллами.
Что происходит при взаимодействии металлов с кислородом?
При взаимодействии металлов с кислородом образуются оксиды металлов, например оксид натрия (Na2O), оксид магния (MgO) и т.д.
Какие соединения металлов с неметаллами являются солями?
Солями являются соединения металлов с кислородом, такие как хлорид натрия (NaCl), сульфат меди (CuSO4) и т.д.
