Металлы являются одной из важнейших групп элементов в химии. Их особенности и свойства делают их незаменимыми во многих областях жизни, начиная от техники и промышленности, и заканчивая медициной и электроникой. Главной особенностью металлов является их высокая проводимость электричества и тепла.
Проводимость электричества является одной из важнейших характеристик металлов. Она объясняется особенной структурой металлической решетки, в которой атомы образуют кристаллическую решетку, а в свободном состоянии образуют электронное облако, которое может свободно перемещаться по всей структуре металла. Благодаря этому свойству, металлы используются в проводниках и электрических контактах, обеспечивая надежное соединение и передачу электрического тока.
Кроме того, металлы обладают высокой реакционной способностью, что определяется их способностью легко отдавать и принимать электроны. Металлы ионизируются при взаимодействии с другими веществами, что обуславливает возможность реакций с кислотами, щелочами, газами и другими неорганическими и органическими соединениями. Это свойство металлов позволяет использовать их в химической промышленности для получения различных продуктов, а также в медицине для производства лекарственных препаратов.
Металлы являются основой современной технологии и нашей повседневной жизни. Их уникальные свойства, такие как проводимость электричества и тепла, а также высокая реакционная способность, делают их незаменимыми во многих областях. Познание особенностей металлов в химии позволяет нам лучше понять их роль и применение в различных сферах деятельности человека.
Металлы в химии: от проводимости электричества до реакционной способности
Металлы являются одной из основных групп химических элементов. Одним из их основных свойств является высокая проводимость электричества. Это связано с особенностями строения и электронной структуры металлов. Атомы металлов обладают относительно небольшим количеством валентных электронов, которые легко могут двигаться внутри кристаллической решетки. Это позволяет металлам быть хорошими проводниками электричества.
Кроме проводимости электричества, металлы также обладают высокой теплопроводностью и благодаря этому находят широкое применение в различных областях, включая электротехнику, строительство и производство инструментов.
Основной химической особенностью металлов является их способность к реакциям. Металлы могут вступать в реакцию с кислородом, образуя оксиды, с кислотами, образуя соли, а также с неметаллами и другими металлами. Реакционная способность металлов может различаться в зависимости от их расположения в периодической таблице и электрохимического ряда. Некоторые металлы, например, такие как золото и платина, очень устойчивы к химическим реакциям и практически не взаимодействуют с другими веществами.
Важно отметить, что химические свойства металлов могут также зависеть от их структуры и микроскопического строения. Например, легирование металлов может изменить их химические и физические свойства, делая их более прочными, устойчивыми к коррозии или придающими им специфические механические свойства.
Проводимость электричества у металлов
Металлы обладают особенностью, называемой проводимостью электричества. Это означает, что они могут передавать электрический ток через свою структуру. Принцип проводимости электричества в металлах основан на наличии свободных электронов, которые двигаются внутри кристаллической решетки.
Вначале, стоит отметить, что свободные электроны в металлах являются результатом особой структуры атомов. Каждый атом металла ограничен своими электронами, которые образуют внутреннюю оболочку. Однако некоторые электроны могут свободно передвигаться между атомами, образуя так называемое "море электронов". Именно эти свободные электроны и отвечают за проводимость электричества.
Важно отметить, что проводимость электричества в металлах определяется не только наличием свободных электронов, но и их движением. При подключении внешнего источника энергии (например, батареи) к металлу, электроны начинают двигаться в сторону положительно заряженного электрода. Это создает электрическую цепь и позволяет току протекать через металл.
За счет высокой подвижности свободных электронов, металлы обладают высокой проводимостью электричества. Это делает их основными материалами для производства электрических проводов и контактов. Благодаря проводимости электричества, металлы широко используются в электротехнике, энергетике и других областях, связанных с передачей энергии и сигналов.
Однако проводимость электричества в металлах не является безграничной. Она определяется различными факторами, такими как температура, состояние поверхности, содержание примесей и т.д. Изменение условий может привести к изменению проводимости и, соответственно, электрических свойств металла.
Термическая и электропроводимость металлов
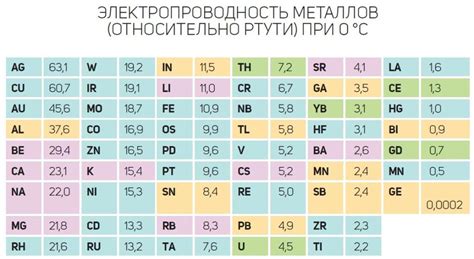
Термическая проводимость металлов является одной из их ключевых особенностей. В сравнении с другими материалами, металлы обладают высокой способностью проводить тепло. Это связано с тем, что в металлической решетке атомы расположены очень близко друг к другу, что способствует эффективному передаче энергии от одной частицы к другой. Из-за этого свойства металлы широко используются в производстве теплопроводных материалов, таких как радиаторы и системы охлаждения.
Электропроводимость также является важной характеристикой металлов. Металлы отличаются от других материалов тем, что их электроны в валентной зоне могут свободно двигаться. Это позволяет металлам проводить электрический ток. Феномен электропроводимости металлов объясняется моделью "свободных электронов", где электроны в металлической решетке могут передвигаться без значительного сопротивления. Благодаря этому свойству, металлы широко применяются в электротехнике и производстве электроники, таких как провода, контакты, и полупроводниковые материалы.
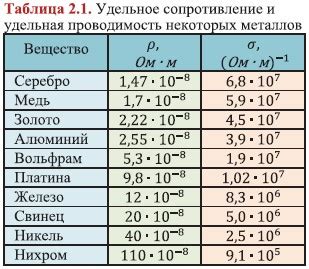
Интересно отметить, что некоторые металлы обладают более высокой термической или электропроводимостью, чем другие. Например, серебро является самым теплопроводным металлом и самым лучшим проводником электричества среди всех известных веществ. Медь также обладает высокими значениями обоих свойств. Это делает данные металлы особенно ценными в различных промышленных и научных областях, где требуется высокая эффективность теплопередачи или передачи электрического тока.
| Металл | Теплопроводность (Вт/м·К) | Электропроводимость (МСм/м) |
|---|---|---|
| Серебро | 429 | 63 |
| Медь | 401 | 59.6 |
| Алюминий | 237 | 37.7 |
Высокая термическая и электропроводимость металлов делает их ценными и необходимыми материалами в различных сферах жизни человека, от промышленности до науки. Их уникальные свойства позволяют использовать их в создании различных устройств, проводников электрического тока и материалов с хорошей теплопроводностью.
Металлы как катализаторы химических реакций
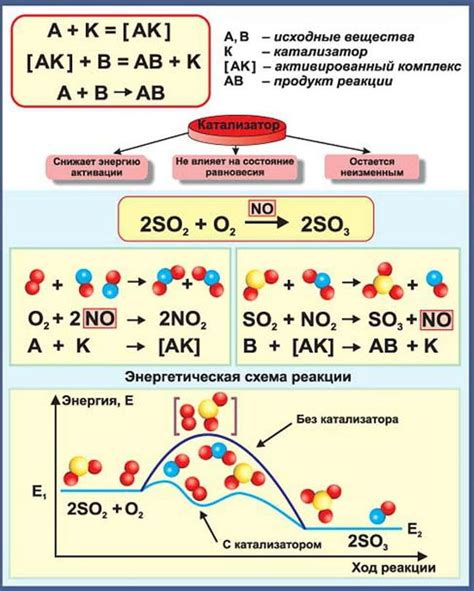
Металлы играют значительную роль в катализе химических реакций. Они способны в значительной мере повысить скорость химических превращений, не участвуя непосредственно в реакции.
Одна из особенностей металлов в качестве катализаторов - их способность образовывать активные центры, на поверхности которых происходят реакции. Активные центры могут химически взаимодействовать с реагентами, изменяя их структуру и обеспечивая более эффективные контакты между молекулами реагентов.
Металлы также способны изменять энергетический барьер реакции - активационную энергию, что позволяет снизить ее энергетическую затратность и повысить скорость протекания процесса. Более того, металлы часто позволяют осуществлять реакции преференциально в определенных направлениях, выбирая наиболее благоприятные пути.
Металлы в качестве катализаторов могут применяться во многих областях химии - от органического синтеза до процессов очистки воздуха и воды. Они обладают широким спектром активности и могут быть использованы для улучшения кинетики самых разнообразных реакций.
Таким образом, металлы играют важную роль в катализе химических реакций, обеспечивая их более эффективное протекание и ускоряя процессы, что находит применение во многих областях науки и промышленности.
Окислительно-восстановительные реакции с участием металлов

Металлы имеют высокую реакционную способность и часто участвуют в окислительно-восстановительных реакциях. В таких реакциях металлы могут выступать в роли окислителей или восстановителей.
В реакциях, где металл является окислителем, он теряет электроны, образуя положительный ион. Примером такой реакции является реакция железа с кислородом при нагревании:
4Fe + 3O2 → 2Fe2O3
В данной реакции железо окисляется, образуя оксид железа (III).
С другой стороны, в реакциях, где металл является восстановителем, он получает электроны, образуя отрицательные ионы. Примером такой реакции является реакция меди с серной кислотой:
2Cu + 2H2SO4 → 2CuSO4 + 2H2O + SO2
В данной реакции медь восстанавливается, образуя сульфат меди.
Окислительно-восстановительные реакции с участием металлов широко применяются в промышленности и в повседневной жизни. Металлы играют важную роль в множестве процессов, таких как электролиз, гальваническая обработка и производство электроэнергии.
Роль металлов в органической химии
Металлы играют важную роль в органической химии, обладая свойствами, которые позволяют им участвовать в различных реакциях и образовывать соединения с органическими молекулами.
Одной из основных ролей металлов в органической химии является их способность катализировать реакции. Большинство металлов, таких как палладий, платина и никель, могут служить каталитическими агентами, активно участвуя в различных реакциях, таких как гидрирование, гидрогенирование и окисление органических соединений.
Кроме того, металлы могут образовывать комплексы с органическими молекулами. Например, некоторые металлы, такие как медь и железо, могут образовывать комплексы с аминокислотами и белками, что играет важную роль в регуляции биологических процессов в организмах.
Еще одной важной ролью металлов в органической химии является их способность образовывать координационные соединения с органическими лигандами. Координационные соединения могут образовываться, например, между металлами и органическими молекулами, содержащими атомы азота, кислорода или серы. Эти соединения имеют широкий спектр применения, включая использование в качестве катализаторов, фармацевтических препаратов и материалов с определенными электронными свойствами.
Таким образом, металлы играют важную роль в органической химии, обладая специфическими свойствами, которые позволяют им взаимодействовать с органическими молекулами и участвовать в различных реакциях и процессах.
Вопрос-ответ

Почему металлы хорошо проводят электричество?
Металлы хорошо проводят электричество из-за своей структуры. У них есть свободные электроны, которые легко двигаются по металлической решетке и создают электрический ток.
Какая особенность металлов отвечает за их высокую теплопроводность?
Металлы обладают высокой теплопроводностью благодаря свободным электронам. Когда металл нагревается, свободные электроны быстро передают тепло от одного атома к другому, обеспечивая эффективную передачу тепла.
Почему металлы склонны к окислению?
Металлы склонны к окислению из-за своей высокой реакционной способности. Они легко отдают электроны другим элементам или соединениям, что приводит к образованию ионов металла и окислителя.
