Одной из основных задач химии является классификация элементов и изучение их свойств. Особый интерес представляет классификация металлических элементов в периодической системе. Металлы имеют широкий спектр физических и химических свойств, которые связаны с их электронной структурой.
Классификация металлических элементов осуществляется на основе расположения их электронных оболочек. Все металлы разделяются на несколько электронных семейств, которые определяют основные свойства элементов в этих группах. Одной из самых известных классификаций является классификация металлов на d-, f-, s- и p-блоки.
Электронные семейства металлических элементов имеют свои уникальные особенности. Например, элементы d-блока характеризуются наличием заполненной d-оболочки электронов, что обуславливает их металлические свойства, такие как хорошая электропроводность и теплопроводность. Элементы f-блока, такие как лантан или актиний, имеют заполненные f-оболочки, что влияет на их магнитные и радиоактивные свойства.
Классификация металлов по электронным семействам позволяет более полно и систематически изучать свойства элементов и их соединений, а также предсказывать их взаимодействие с окружающей средой и другими веществами.
Классификация электронных семейств металлических элементов

Металлические элементы характеризуются особыми свойствами, связанными с их электронными конфигурациями. Электронные семейства металлических элементов можно классифицировать по различным признакам, таким как количество электронов на внешней энергетической оболочке и размер электронного облака.
Одной из основных классификаций является деление металлов на переходные и благородные. Переходные металлы обладают специфическими электронными конфигурациями, которые позволяют им образовывать комплексы с другими веществами и проявлять разнообразные окислительно-восстановительные свойства. Благородные металлы, такие как золото, платина и серебро, имеют полностью заполненные электронные оболочки и поэтому обладают высокой стабильностью и инертностью.
Металлы также можно классифицировать по количеству внешних электронов на энергетической оболочке. Существует несколько групп металлов: щелочные металлы, щелочноземельные металлы и переходные металлы. Щелочные металлы, такие как литий, натрий и калий, имеют один внешний электрон, что делает их очень реакционными и способными легко образовывать соединения с другими элементами. Щелочноземельные металлы, такие как магний, кальций и барий, имеют два внешних электрона, что делает их менее реакционными, но все же способными образовывать соединения. Переходные металлы имеют переменное количество внешних электронов и образуют широкий класс соединений.
Классификация электронных семейств металлических элементов позволяет лучше понять их свойства и взаимодействие с другими веществами. Это важно для изучения и применения металлов в различных областях, таких как металлургия, электроника и катализ.
Щелочные и щелочноземельные элементы
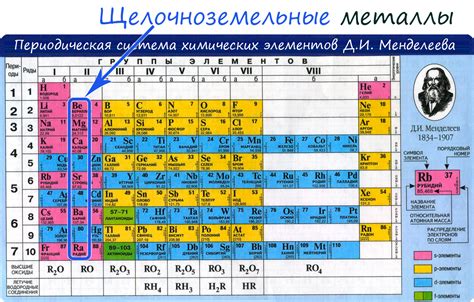
Щелочные и щелочноземельные элементы - это группы металлических элементов, которые расположены в левой части периодической системы элементов. Они обладают общими характеристиками и свойствами, которые делают их уникальными и полезными.
Щелочные элементы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой реактивностью и активностью, что связано с наличием одной лишь электрона во внешней оболочке атома. Щелочные элементы активно взаимодействуют с водой, выделяя водород.
Щелочноземельные элементы включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти элементы также обладают активной химической реактивностью, но они менее реактивны, чем щелочные элементы. Щелочноземельные элементы очень важны в промышленности и имеют широкое применение, например, в производстве сплавов и легированных сталей.
Оба этих класса элементов имеют одну внешнюю электронную оболочку, что делает их химически похожими и позволяет им образовывать стабильные соединения с другими элементами. Эти элементы также имеют низкую плотность и низкую температуру плавления, что делает их легкими и переносными.
Переходные металлы

Переходные металлы – это класс элементов, обладающих особыми химическими и физическими свойствами. Они расположены в периодической таблице между главными и правыми элементами. К этому классу относятся такие элементы, как железо, медь, цинк, никель, кобальт, хром и другие.
Одной из особенностей переходных металлов является наличие внутренней d-оболочки, которая влияет на их химические свойства. Эти элементы обладают высокой прочностью, твердостью, плавкостью и коррозионной стойкостью. Они способны образовывать ионы с разными валентностями, что позволяет им образовывать разнообразные соединения.
Переходные металлы широко используются в промышленности и технике благодаря своим уникальным свойствам. Например, железо отличается высокой прочностью и является основным элементом в производстве стали. Медь применяется в электротехнике и электронике, благодаря своей электропроводности. Никель используется в производстве литейных сплавов и аккумуляторов.
Также переходные металлы являются важными катализаторами в химической промышленности. Они способствуют ускорению химических реакций и увеличению их эффективности. Кроме того, многие переходные металлы обладают яркими цветами, что делает их популярными в ювелирном искусстве и применении в качестве пигментов.
Постпереходные металлы

Постпереходные металлы – это группа металлических элементов, относящихся к блоку d периодической системы элементов. Они располагаются между благородными металлами и переходными металлами. Всего в этой группе находится 14 элементов.
Постпереходные металлы обладают рядом характерных свойств. Например, они имеют высокую электропроводность и теплопроводность, что делает их незаменимыми в промышленности. Они также обладают подвижными ионами, что позволяет им образовывать различные степени окисления.
Внешние электронные оболочки постпереходных металлов могут перекрываться различными оболочками и предоставлять элементам большую энергетическую нестабильность. Это может приводить к различным необычным свойствам постпереходных металлов, таким как изменение цвета в разных окружающих условиях.
Постпереходные металлы широко используются в различных отраслях промышленности, включая производство автомобилей, электронику, химию и металлургию. Они также играют важную роль в качестве катализаторов в химических реакциях и имеют множество других применений благодаря своим уникальным свойствам.
Лантаноиды и актиноиды
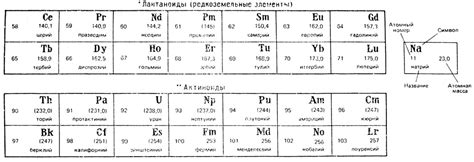
Лантаноиды и актиноиды являются группами в периодической таблице химических элементов, которые расположены под основным блоком. Эти группы включают серию элементов, начиная с лантана (La) и актиния (Ac) и продолжаются до лавреция (Lr) и лоуренсия (Rf) соответственно.
Лантаноиды и актиноиды обладают наиболее значимыми свойствами 4f- и 5f-электронных конфигураций. Элементы этих групп обладают схожими свойствами, такими как металлический блеск, высокая плотность и температура плавления.
В периодической таблице лантаноиды и актиноиды расположены в специально выделенных рядов и имеют свою систему нумерации. Например, лантаноиды обозначаются символом "La" и последующими цифрами 57-71, а актиноиды - "Ac" и цифрами 89-103.
Свойства лантаноидов и актиноидов связаны с их электронными конфигурациями и способностью образовывать ионы с разными степенями окисления. Эти элементы могут образовывать стабильные соединения с другими элементами, что делает их значимыми для различных индустриальных и научных применений, включая катализаторы, магниты и ядерные реакторы.
- Лантаноиды: лантан (La), церий (Ce), прасеодим (Pr), неодим (Nd), прометий (Pm), самарий (Sm), европий (Eu), гадолиний (Gd), тербий (Tb), диспрозий (Dy), гольмий (Ho), эрбий (Er), тулий (Tm), иттербий (Yb) и лютеций (Lu).
- Актиноиды: актиний (Ac), торий (Th), протактиний (Pa), уран (U), нептуний (Np), плутоний (Pu), америций (Am), кюрий (Cm), берклий (Bk), калифорний (Cf), эйнштейний (Es), фермий (Fm), менделевий (Md), нобелий (No), лоуренсий (Lr).
Лантаноиды и актиноиды имеют многообразные и интересные свойства, которые напрямую связаны с их электронной структурой и положением в периодической таблице. Изучение этих элементов является важным для понимания химических и физических особенностей и развития новых технологий и материалов.
Другие металлические элементы
Медь – это очень важный металлический элемент, который используется во множестве отраслей. Он хорошо проводит электричество и тепло, что делает его идеальным материалом для электрических проводов. Медные сплавы широко применяются в производстве монет, ювелирных изделий и кухонной утвари.
Цинк – это еще один металл, который имеет широкое применение. Цинк используется в производстве коррозионностойких покрытий, таких как цинкование, которое защищает металл от ржавчины. Он также используется в батареях, а также в производстве сплавов, стальных конструкций и автомобильных деталей.
Магний – легкий и прочный металл, который широко используется в авиационной и автомобильной промышленности. Магниевые сплавы обладают высокой прочностью при низком весе, что делает их идеальными для производства легких автомобильных деталей, таких как кузов и двигательные блоки.
Ртуть – это единственный металл, который находится в жидком состоянии при комнатной температуре. Из-за этого свойства ртуть широко используется в приборах для измерения давления и термометрах. Однако из-за своей токсичности, ртуть требует особого обращения и хранится в специальных контейнерах.
Алюминий – легкий, прочный и устойчивый к коррозии металл, который широко применяется в различных отраслях. Он используется для производства авиационных и автомобильных частей, строительных материалов, упаковки и многого другого. Алюминий также можно встретить в повседневных предметах, таких как посуда, бытовая техника и мебель.
Вопрос-ответ

Какие металлические элементы относятся к электронным семействам?
К электронным семействам относятся все металлические элементы периодической таблицы.
Чем отличается электронное семейство от химического семейства?
Электронное семейство определяется по количеству электронов в последней электронной оболочке металлического элемента, в то время как химическое семейство определяется по химическим свойствам элемента.
Какая основная классификация электронных семейств металлических элементов?
Металлические элементы классифицируются на основе количества электронов в их последней электронной оболочке. Всего существует 7 электронных семейств: 1A, 2A, 3B, 4B, 5B, 6B и 7B.
Какова химическая активность металлических элементов из разных электронных семейств?
Химическая активность металлических элементов уменьшается с увеличением номера электронного семейства. Элементы первого семейства (1A) самые активные, а элементы седьмого семейства (7B) наиболее пассивные.
Сколько электронов находится в последней электронной оболочке элементов 1A электронного семейства?
В последней электронной оболочке элементов 1A электронного семейства находится один электрон.
