Атом натрия является одним из наиболее распространенных и широко используемых элементов в химии и промышленности. Его атомный номер составляет 11, что означает, что у него 11 электронов. Электронная формула атома натрия отображает расположение этих электронов на энергетических уровнях.
Электронная формула атома натрия имеет вид 2-8-1, что означает, что на первом энергетическом уровне находится 2 электрона, на втором - 8 электронов, а на третьем - 1 электрон. Такое расположение электронов определяет химические и физические свойства атома натрия.
Основное электронное облако атома натрия находится на внешнем энергетическом уровне, где находится всего 1 электрон. Этот электрон является подвижным и легко может переходить на другие атомы, что делает атом натрия очень реактивным и подверженным химическим реакциям. Благодаря этим свойствам атом натрия широко применяется в производстве различных соединений и материалов.
Натрий обладает также множеством других химических и физических свойств, таких как высокая электропроводность, способность образовывать ионы, горение воздухе и реакция с водой. Все эти характеристики делают атом натрия неотъемлемой частью нашей жизни и промышленности, применение которого широко разнообразно и важно для многих отраслей науки и технологий.
Строение атома натрия
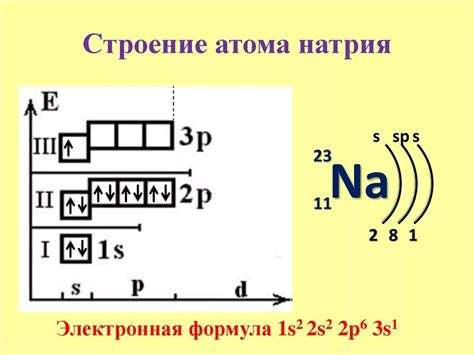
Атом натрия состоит из ядра и электронной оболочки. Ядро атома натрия содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Число протонов и нейтронов в ядре определяет массовое число атома.
Вокруг ядра атома натрия располагаются электроны, которые имеют отрицательный заряд. Количество электронов в атоме натрия определяет его атомный номер. Он также равен числу протонов в ядре и определяет положение натрия в таблице химических элементов.
Атом натрия имеет две оболочки электронной оболочки: внутреннюю и внешнюю. Внутренняя оболочка содержит 2 электрона, а внешняя оболочка содержит 8 электронов. Поэтому в общей сложности у атома натрия 12 электронов.
Структура атома натрия и его электронная формула, где внутренняя оболочка обозначается как 2, внешняя оболочка обозначается как 8 (2,8), помогают понять химические свойства и реактивность натрия. Атом натрия часто образует положительные ионы, отдавая свой внешний электрон, чтобы достичь стабильной электронной конфигурации.
Понятие атома
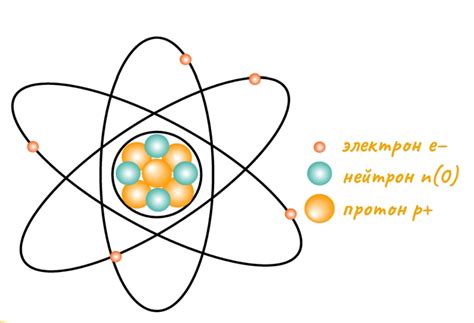
Атом - это наименьшая частица вещества, обладающая его химическими свойствами. Атомы являются основными строительными блоками всех веществ и существуют в состоянии постоянного движения. Они состоят из ядра, которое содержит протоны и нейтроны, и электронной оболочки, в которой находятся электроны.
Внутри атома протоны и нейтроны находятся в ядре, которое имеет положительный заряд. Протоны имеют положительный заряд, а нейтроны не имеют заряда. В то же время электроны находятся на энергетических уровнях вокруг ядра и имеют отрицательный заряд. Электроны располагаются в оболочках, которые могут вместить разное количество электронов. Наиболее близка к ядру оболочка может вмещать максимум 2 электрона, следующая оболочка - 8 электронов и так далее.
Количество протонов в ядре определяет химические свойства атома и определяет его атомный номер. Номер атома также указывает на количество электронов в нормальном состоянии, так как атом стремится быть электронейтральным, имея равное число электронов и протонов. Однако, атом может потерять или получить электроны и стать ионом, имеющим положительный или отрицательный заряд.
Строение атома натрия

Атом натрия является элементарной частицей, обладающей определенными физическими и химическими свойствами. Он состоит из положительно заряженного ядра и отрицательно заряженных электронов, движущихся по орбитам вокруг ядра. Ядро атома натрия содержит протоны и нейтроны, которые определяют его массу и являются источником его положительного заряда.
Орбиты, по которым движутся электроны, различаются по энергии. В атоме натрия первая энергетическая оболочка может вместить до 2 электронов, а вторая - до 8 электронов. Внешняя оболочка называется валентной оболочкой и в ней находится всего 1 электрон. Именно этот электрон является основным участником химических реакций, так как именно он находится на наибольшем удалении от ядра и наиболее легко может участвовать во взаимодействиях с другими атомами.
Зарядовое состояние атома натрия, как и любого другого атома, в основном равно нулю из-за равенства положительного заряда ядра и отрицательного заряда электронов. Однако в некоторых случаях, атом натрия может потерять свой валентный электрон и приобрести положительный заряд. Это происходит, например, при образовании ионов натрия, которые широко используются в различных химических реакциях и обладают высокой реакционной активностью.
В целом, структура и строение атома натрия являются основными особенностями, определяющими его свойства и способность участвовать в химических реакциях. Понимание этих особенностей позволяет уяснить взаимодействие натрия с другими веществами и его роль в различных процессах, происходящих в природе и в жизни человека.
Оболочки атома натрия
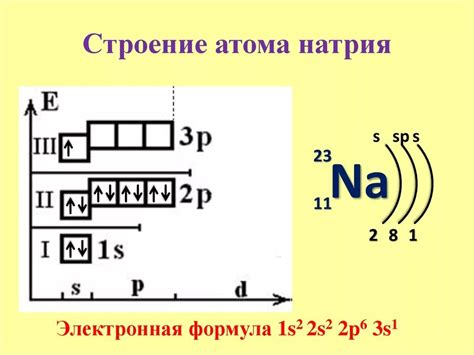
Атом натрия состоит из ядра, вокруг которого располагаются оболочки электронов. Каждая оболочка содержит определенное количество электронов, которые движутся по орбитам вокруг ядра.
Первая оболочка атома натрия заполняется двумя электронами. Она находится ближе всего к ядру и обозначается буквой K. Вторая оболочка вмещает до восьми электронов и обозначается буквой L.
Из-за своей электроотрицательности натрий стремится отдать один электрон из внешней оболочки. Это делает его химически активным элементом, способным образовывать различные соединения.
Оболочки атома натрия могут быть представлены в виде электронной формулы: К (2) Л (8) М (1). Это означает, что в первой оболочке находятся 2 электрона, во второй - 8 электронов, а в третьей оболочке - 1 электрон.
Атом натрия с одной внешней электронной оболочкой активно вступает в химические реакции, образуя ионы Na+. Это позволяет натрию образовывать стабильные соединения и принимать участие во многих биологических и химических процессах.
Электронная формула атома натрия

Натрий (Na) - химический элемент с атомным номером 11 и массовым числом 23. Он относится к группе щелочных металлов и находится во втором периоде таблице Менделеева.
Электронная формула атома натрия определяет распределение электронов по энергетическим уровням. Она выглядит следующим образом: 1s^2 2s^2 2p^6 3s^1. Это означает, что у атома натрия на первом энергетическом уровне находится 2 электрона, на втором - 8 электронов, а на третьем - 1 электрон.
Электронная формула атома натрия может быть использована для определения его электронной конфигурации, которая характеризует организацию электронов в оболочках вокруг ядра атома.
Атом натрия имеет относительно низкую электроотрицательность и легко отдает один электрон из внешней энергетической оболочки. Поэтому он стремится образовывать соединения с элементами, обладающими большей электроотрицательностью, например, с хлором (Cl). Таким образом, натрий образует ион Na+ во многих соединениях.
- Атомный радиус натрия составляет около 186 пикометров;
- Молярная масса натрия равна примерно 23 г/моль;
- Натрий обладает металлическим блеском и является хорошим проводником электричества;
- Этот элемент широко используется в промышленности, особенно в производстве солей, щелочей и стекла.
Определение электронной формулы

Электронная формула атома натрия представляет собой удобное графическое изображение атома натрия и его электронной структуры. Она показывает распределение электронов в оболочках вокруг ядра атома и помогает наглядно представить его электронную конфигурацию.
Основные элементы электронной формулы включают ядро атома, обозначенное символом Na, и электронные оболочки, представленные в виде круговых орбит, на которых располагаются электроны.
В электронной формуле атома натрия обозначается число электронов в каждой оболочке. В первой электронной оболочке находится 2 электрона, во второй оболочке - 8 электронов, а в третьей оболочке - 1 электрон.
Отметим, что натрий имеет электронную конфигурацию [Ne]3s1, что означает, что первые 10 электронов (2 электрона в первой оболочке и 8 электронов во второй оболочке) аналогичны электронной конфигурации инертного газа неона (Ne) и третий электрон находится в третьей оболочке (3s).
- Ядро атома (Na)
- Первая электронная оболочка (2 электрона)
- Вторая электронная оболочка (8 электронов)
- Третья электронная оболочка (1 электрон)
Электронная формула атома натрия позволяет упростить и улучшить понимание его строения и расположения электронов. Она также является основой для дальнейшего изучения и понимания химических свойств и реакций натрия.
Электронная формула атома натрия

Атом натрия имеет электронную формулу, отражающую распределение электронов по энергетическим уровням и подуровням. Электронная формула атома натрия можно записать как 1s^2 2s^2 2p^6 3s^1.
Атом натрия имеет 11 электронов. Первые два электрона находятся на первом энергетическом уровне в s-подуровне. Вторые два электрона находятся на втором энергетическом уровне, также в s-подуровне. Следующие шесть электронов занимают второй энергетический уровень в p-подуровне. Один электрон остается на третьем энергетическом уровне в s-подуровне.
Электронная формула атома натрия позволяет определить его электронную конфигурацию и его химические свойства. Натрий относится к группе щелочных металлов и имеет один валентный электрон в s-подуровне. Это делает натрий реактивным металлом, способным образовывать положительные ионы, обменивая валентный электрон с другими атомами.
Электронная формула атома натрия позволяет также определить его энергетические уровни и возможные переходы электронов между ними. Натрий обладает свойствами, которые связаны с его электронной структурой. Например, атом натрия может испускать яркий оранжевый свет при возбуждении его электронов и переходе их на более высокие энергетические уровни, а затем обратном переходе.
Внешняя оболочка атома натрия и ее электронная формула
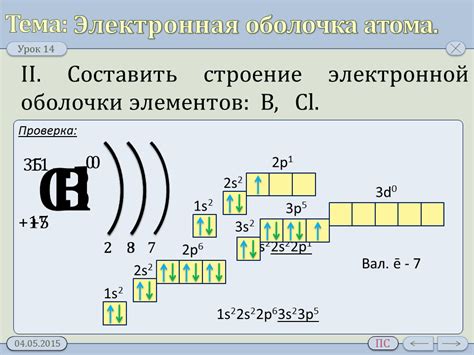
Натрий является химическим элементом, который обладает атомным номером 11 в периодической таблице. В его внешней оболочке, также называемой валентной оболочкой, находятся всего два электрона. Это означает, что атом натрия имеет электронную формулу 2-8-1.
На первом энергетическом уровне находится всего один электрон, а на втором – восемь электронов. Это объясняется тем, что первый энергетический уровень может вместить максимум два электрона, а второй – восемь. Таким образом, основная электронная конфигурация натрия состоит из электронной формулы 2-8-1, где "2" обозначает количество электронов на первом энергетическом уровне, "8" – количество электронов на втором энергетическом уровне, а "1" – количество электронов на внешней оболочке.
Электроны, находящиеся на внешней оболочке атома натрия, называются валентными электронами. Именно они определяют химические свойства и реактивность натрия. Валентный электрон на внешней оболочке натрия обладает отрицательным зарядом и способен вступать в химические связи с другими атомами. Благодаря этому, натрий формирует различные соединения и реагирует с другими веществами.
Электронная формула атома натрия, показывающая количество электронов на каждом энергетическом уровне, не только помогает определить валентность атома, но и позволяет понять его атомные свойства. Важно отметить, что электронная формула атома натрия является основой для многих химических расчетов и реакций, а также используется в химических формулах соединений, в которых присутствует натрий.
Внешняя оболочка атома натрия
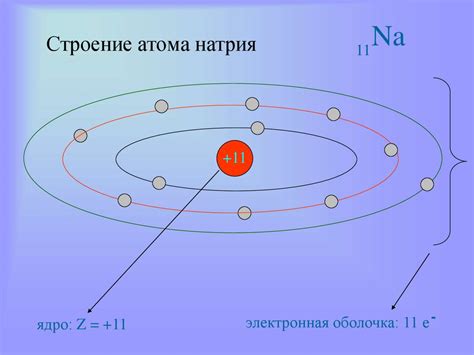
Атом натрия имеет электронную формулу 2-8-1, что означает, что у него есть две электрона в первом энергетическом уровне, восемь электронов во втором уровне и один электрон в третьем уровне.
Внешний энергетический уровень атома натрия содержит всего один электрон, которому требуется всего один дополнительный электрон, чтобы заполнить его до максимального значения. Поэтому атом натрия стремится отдать этот электрон, чтобы достичь стабильной электронной конфигурации.
Внешний электрон атома натрия имеет свободную энергию и может легко участвовать в химических реакциях. Из-за этого свойства, атом натрия активно реагирует с другими атомами и может образовывать ион натрия, потеряв этот внешний электрон.
Образование положительного иона натрия позволяет атому стабилизировать свою электронную конфигурацию, а также образовывать ионы водорода, кислорода и других элементов. Это способствует образованию различных соединений, таких, как хлорид натрия.
Электронная формула оболочки атома натрия

Атом натрия имеет электронную формулу 2-8-1, что означает, что у него на внешней энергетической оболочке находится один электрон. Внешняя энергетическая оболочка - это оболочка, расположенная самым дальним от ядра атома слоем электронов.
Один электрон на внешней оболочке делает атом натрия активным металлом и позволяет ему легко взаимодействовать с другими веществами. Благодаря наличию свободного электрона, атом натрия обладает высокой химической активностью и может образовывать ионы, вступая в химические реакции.
Электронная формула атома натрия указывает на его положение в периодической системе элементов. Натрий имеет атомный номер 11, что означает, что у него в атоме находятся 11 электронов. Отчетливую электронную формулу можно прочитать как число электронов на каждом энергетическом уровне, начиная с ближайшего к ядру.
Исходя из электронной формулы атома натрия, можно сказать, что у него внутренние энергетические уровни заполнены полностью: первый уровень содержит 2 электрона, а второй уровень - 8 электронов. Всего у атома натрия 11 электронов, что соответствует его атомному номеру.
Вопрос-ответ

Как выглядит электронная формула атома натрия?
Электронная формула атома натрия выглядит следующим образом: 1s2 2s2 2p6 3s1. Это означает, что у атома натрия 11 электронов, распределенных по энергетическим уровням: 2 электрона на первом уровне, 8 электронов на втором уровне и 1 электрон на третьем уровне.
Чем отличается электронная формула атома натрия от других атомов?
Особенностью электронной формулы атома натрия является наличие 1 электрона на третьем энергетическом уровне. Это делает атом натрия химически активным и способным образовывать ионный и ковалентный связи с другими атомами.
Какие свойства имеет атом натрия, обусловленные его электронной формулой?
Атом натрия имеет свойство образовывать катионы с однозарядным положительным зарядом, отдавая электрон с третьего энергетического уровня. Это свойство обусловлено наличием 1 электрона на этом уровне. Кроме того, атом натрия может образовывать ионные и ковалентные связи с другими атомами, что позволяет ему участвовать в химических реакциях и образовывать соединения, такие как хлорид натрия (NaCl) или гидроксид натрия (NaOH).
