Изучение электронной структуры металлов играет ключевую роль в технологических и научных приложениях. Одной из важных составляющих этой структуры является внешний электронный слой, который обеспечивает химическую активность металлов.
Внешний электронный слой металлов отличается от внутренних слоев своим поведением и взаимодействием с другими атомами. Электроны на внешнем слое, называемом также валентным слоем, имеют высокую энергию и могут легко перемещаться между атомами.
Особенности валентных электронов в металлах обусловлены специфическими свойствами металлической связи. Валентные электроны образуют «облако» электронов, которое окружает положительно заряженные ядра атомов. Это позволяет электронам на внешнем слое свободно двигаться внутри металлической структуры.
Важно отметить, что электроны на внешнем слое металлов не связаны с конкретными атомами и, следовательно, не привязаны к определенным положениям в кристаллической решетке металла. Вместо этого они формируют электронное «море», которое является ответственным за проводимость металлов и их гибкость в формировании различных структур.
Таким образом, особенности электронов на внешнем слое у металлов определяют их свойства и поведение в процессе взаимодействия с другими веществами. Изучение этих особенностей является основой для разработки новых материалов и технологий в металлургии, электронике и других отраслях промышленности.
Расположение электронов
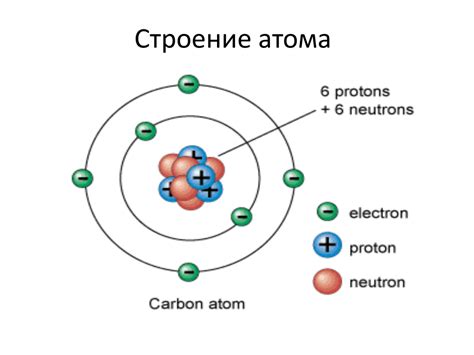
Электроны на внешнем слое у металлов, который называется валентной оболочкой, располагаются по определенным правилам и формируют химические связи. В общем случае, валентная оболочка может содержать от 1 до 8 электронов.
Первая группа элементов (алкалии) имеет один электрон на внешнем слое, вторая группа (алкалиноземельные металлы) - два электрона, третья группа (бор, алюминий) - три электрона, четвертая группа (углерод, кремний) - четыре электрона.
Валентные электроны являются наиболее активными электронами в атоме. Они определяют химические свойства элементов и их способность образовывать соединения с другими атомами. Количество валентных электронов определяет, какие связи могут образовываться.
- Валентные электроны располагаются на "наружной" оболочке, ближе к ядру.
- Периодическая система элементов показывает, сколько электронов находится на каждом слое атома.
- Валентные электроны могут быть переданы или приняты другими атомами, образуя ионные связи, или могут обмениваться, образуя ковалентные связи.
Расположение электронов на внешнем слое влияет на способность металлов проводить электричество и тепло, образовывать сплавы.
Распределение электронов в атоме металла
Электроны являются элементарными частицами атома, которые обладают отрицательным электрическим зарядом. В атоме металла электроны распределены по энергетическим уровням и оболочкам. Заполнение электронными оболочками начинается с наиболее близкой к ядру оболочки и продолжается на внешние оболочки.
На внешнем слое у металлов находится валентная оболочка, которая играет ключевую роль в химических реакциях. Валентная оболочка содержит свободные электроны, которые легко перемещаются и образуют электронное облако на поверхности металла.
Количество электронов на внешнем слое у металлов определяет их химические свойства и способность образовывать соединения. Например, металлы с одним или двумя электронами на внешнем слое обычно образуют положительные ионы, которые легко переходят в раствор или реагируют с другими веществами.
Распределение электронов на внешнем слое у металлов влияет на их проводимость электричества и тепла. Электроны на внешнем слое обладают большей подвижностью и легко передвигаются под действием электрического поля. Именно благодаря этому свойству металлы являются хорошими проводниками электричества.
Важно отметить, что внешний слой электронов у металлов может быть заполнен не полностью. Это явление называется "неполным заполнением внешней оболочки". Неполное заполнение внешней оболочки делает металлы реактивными и способными образовывать соединения с другими элементами.
Энергетические уровни
Энергетические уровни – это квантовые состояния, в которых могут находиться электроны на внешнем слое у атомов металлов. Каждый электрон занимает конкретный энергетический уровень, определяющий его расположение в атоме и его поведение во внешнем электронном облаке.
Количество энергетических уровней на внешнем слое определяется общим числом электронов, которое может вместить данный слой. На первом энергетическом уровне может находиться не более 2 электронов, на втором – не более 8 электронов, на третьем – не более 18 электронов и так далее.
На самом высоком заполненном энергетическом уровне находятся валентные электроны, которые обладают наибольшей энергией и участвуют в химических реакциях. Именно их поведение определяет электроны металлов и их химические свойства.
Энергия электрона на каждом энергетическом уровне может быть измерена и выражена в электрон-вольтах (эВ). Чем больше значения энергии электрона на данном уровне, тем дальше он находится от ядра и тем более свободно он движется в атоме металла. Диапазон энергий электронов на внешнем слое металлов может быть широким, что влияет на их химическую активность и способность образовывать соединения.
Валентная зона и электронное облако
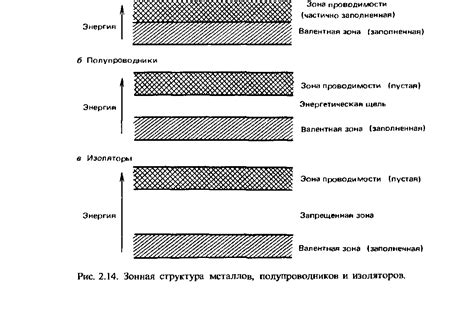
Валентная зона - это энергетический уровень внешней оболочки атомов металлов, в котором находятся валентные электроны. Эти электроны обладают свободным движением и отвечают за химические свойства металлов.
Электронное облако - это область вокруг атомов металлов, где находятся электроны, образующие свободные электронные пары. Это облако состоит из валентных электронов, которые могут свободно перемещаться по кристаллической решетке металла.
Валентная зона и электронное облако являются основными факторами, определяющими свойства металлов. Благодаря наличию свободных электронов в валентной зоне, металлы обладают высокой электропроводностью и теплопроводностью, пластичностью и металлическим блеском.
Электронное облако обеспечивает металлам межатомную связь, которая обеспечивает прочность и устойчивость структуры металла. Электроны образуют электронные пары, которые формируют связи между атомами металла и позволяют им держаться вместе.
Валентная зона и электронное облако играют важную роль в различных технологических процессах, связанных с металлами. Например, наличие свободных электронов позволяет проводить электрохимические реакции, использовать металлы для проведения электрического тока и создавать светящиеся материалы.
Поведение электронов

Электроны, находящиеся на внешнем слое металлов, обладают своими особенностями в поведении. Они могут быть свободными или связанными с атомами металла. Свободные электроны не привязаны к конкретным атомам и могут двигаться внутри металла без препятствий. Они образуют электронный газ, который отвечает за проводимость металлов.
Электроны на внешнем слое металлов также могут быть связанными с атомами и образовывать так называемую валентную оболочку. Эти электроны обладают определенной энергией, которая зависит от связи с атомами. Взаимодействие между связанными электронами определяет химические свойства металлов, такие как устойчивость к окислению и реактивность.
Связанные электроны на внешнем слое металла могут также образовывать межатомные связи с другими атомами. Это позволяет металлам образовывать различные структуры, такие как кристаллическая решетка. Межатомные связи обуславливают физические свойства металлов, такие как твердость, пластичность и теплопроводность.
В целом, поведение электронов на внешнем слое у металлов играет важную роль в определении их свойств и возможностей использования в различных областях науки и техники.
Сопротивление движению электронов
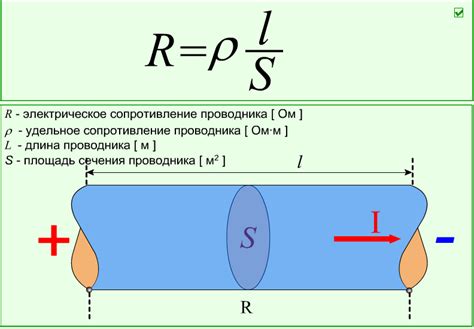
Сопротивление является одной из важнейших характеристик внешних электронов металла. Сопротивление движению электронов обусловлено взаимодействием электронов с решеткой кристаллической структуры металла. Электроны сталкиваются с атомами решетки, что вызывает их рассеивание и затрудняет их свободное движение.
Сопротивление движению электронов проявляется в виде теплового движения электронов в проводниках, появления тепла при протекании тока и падения напряжения вдоль проводника. Оно зависит от множества факторов, таких как температура, концентрация электронов, уровень примесей и др.
Свойства сопротивления движению электронов могут быть измерены с помощью различных методов, например, методом измерения электрического сопротивления проводника. Этот метод позволяет определить сопротивление проводника на основе его геометрических и электрических параметров.
- Количественное выражение сопротивления движению электронов представляет собой величину, обратную проводимости металла. Оно измеряется в единицах ома и обозначает силу, с которой электроны препятствуют внешнему электрическому полю.
- Температурная зависимость сопротивления металла имеет выраженный характер. При повышении температуры, сопротивление металла растет, что связано с увеличением взаимодействия электронов с решеткой.
- Роль сопротивления движению электронов влияет на электрические свойства материалов и на эффективность их использования в различных устройствах и технологиях. Понимание этого явления позволяет создавать материалы с желаемыми электроэнергетическими характеристиками.
Взаимодействие электронов
Электроны на внешнем слое металла взаимодействуют друг с другом и с окружающей средой, создавая разнообразные эффекты и явления. Одним из ключевых явлений является электронное размещение, которое представляет собой упорядоченное распределение электронов по энергетическим уровням.
Взаимодействие электронов также связано с формированием электронных облаков, которые окружают атомы металла. Эти облака являются зонами с высокой плотностью электронов и формируют поверхностный слой металла, называемый внешним слоем. Электроны на внешнем слое металла обладают большей подвижностью и определяют его электрические и тепловые свойства.
Важным аспектом взаимодействия электронов является образование связей между ними. Электроны на внешнем слое металла могут образовывать ковалентные связи, в результате которых происходит обмен электронами между атомами. Эти связи обеспечивают стабильность и прочность металлической структуры.
Кроме того, электроны на внешнем слое металла взаимодействуют с окружающими ионами и молекулами. Это приводит к возникновению различных электрохимических реакций, включая окислительно-восстановительные процессы. Электроны могут передаваться между различными частями металла и окружающей среды, что способствует возникновению электролитических свойств металла.
Таким образом, взаимодействие электронов на внешнем слое металлов играет ключевую роль в определении их физических и химических свойств, а также в формировании различных явлений и реакций, которые возникают в металлической структуре и ее окружении.
Вопрос-ответ

Какие свойства электронов на внешнем слое металлов определяют их химическую активность?
Свойства электронов на внешнем слое металлов определяют их химическую активность. Эти электроны называются валентными электронами, и именно они участвуют в химических реакциях металлов. Их наличие и поведение определяют способность металлов образовывать соединения с другими элементами, образовывать ионы, а также проводить электрический ток.
Как валентные электроны обеспечивают проводимость в металлах?
Валентные электроны обеспечивают проводимость в металлах. Они свободно передвигаются между атомами металла и образуют так называемое "электронное море". Это позволяет электронам протекать через металл и создавать электрический ток. Благодаря этому свойству, металлы являются хорошими проводниками электричества и тепла.
