Металлы 2а группы периодической таблицы элементов являются активными химическими веществами, которые реагируют с водой. Однако есть несколько исключений, когда эти металлы не проявляют такую активность. Тем не менее, большинство металлов 2а реагируют с водой и могут вызывать различные химические реакции.
Магний (Mg) - один из таких металлов, который не реагирует с водой при нормальных условиях. Однако, если вода находится в парообразном состоянии, магний может взаимодействовать с ней, образуя оксид магния. Также, реакция магния с водой может происходить при высокой температуре и давлении.
Кальций (Ca) - ещё один металл, который, несмотря на свою активность, не реагирует с водой при комнатной температуре и давлении. Однако, если вода нагревается или реакция происходит в присутствии кислорода, кальций может реагировать с водой, образуя гидроксид кальция и выделяя водород.
Металлы 2а реагируют с водой, так как они обладают способностью отдавать электроны и образовывать положительные ионы. Это позволяет им образовывать различные соединения с другими элементами, в том числе с водой. Реакция с водой может быть сопровождена выделением газа, образованием осадка или изменением цвета воды. Такие реакции имеют важное значение в химической промышленности и научных исследованиях.
Вещества 2а группы и их реакция с водой
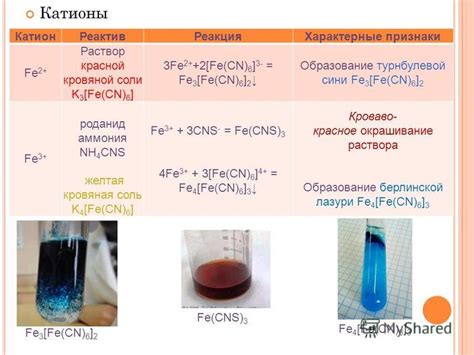
Вещества 2а группы периодической системы химических элементов, такие как магний (Mg), цинк (Zn), кадмий (Cd) и свинец (Pb), обладают интересными свойствами и способностью реагировать с водой.
Магний является химическим элементом, расположенным во 2а группе периодической системы. При контакте с водой магний реагирует и образует оксид магния и водород. Реакция протекает с выделением тепла и обычно сопровождается плаванием металлического магния на поверхности воды.
Цинк, также относящийся к 2а группе элементов, образует с водой оксид цинка и водород. Реакция протекает с выделением тепла, однако цинк не плавает на поверхности воды, а растворяется в ней, образуя ионы цинка.
Кадмий, элемент, находящийся в 2а группе, реагирует с водой, образуя оксид кадмия и водород. Но в отличие от магния и цинка, кадмий имеет более медленную скорость реакции с водой и не вызывает столь интенсивного выделения тепла.
Свинец, последний элемент 2а группы, при контакте с водой покрывается слоем оксида свинца, но реакция не протекает с такой высокой скоростью, как у магния, цинка и кадмия.
Реакции этих веществ группы 2а с водой проходят с выделением водорода и образованием соответствующих оксидов. Они интересны с точки зрения применения данных металлов и их соединений в различных отраслях промышленности и научных исследований.
Металлы 2а группы периодической таблицы
Металлы 2а группы периодической таблицы - это важная группа элементов, которая включает в себя металлы, среди которых наиболее известными являются магний (Mg) и цинк (Zn). Эти металлы обладают рядом уникальных свойств и находят широкое применение в различных сферах.
Магний является одним из наиболее легких металлов и встречается в природе в виде ряда соединений. Он обладает высокой прочностью и низкой плотностью, что делает его отличным материалом для производства легких конструкций, таких как авиационные и автомобильные детали. Кроме того, магний имеет низкую коррозионную активность и широко используется в производстве сплавов, например, с алюминием и цинком.
Цинк также является металлом 2а группы и обладает рядом уникальных свойств. Он является химически стабильным и имеет высокую устойчивость к коррозии. Цинк широко применяется в гальванической отрасли, а также в производстве сплавов, анодов и защитных покрытий. Кроме того, цинк используется в производстве батарей, солнечных панелей и других электронных устройств.
Металлы 2а группы имеют значительное значение в промышленности и научных исследованиях. Они являются неотъемлемой частью современных технологий и находят применение в различных областях, таких как энергетика, медицина, строительство и многие другие.
Химические свойства металлов 2а группы

Металлы 2а группы располагаются в периодической системе элементов между магнием и цинком. Они обладают сходными химическими свойствами и образуют оксиды с формулой MО, где M обозначает металл этой группы.
Металлы 2а группы обладают способностью реагировать с водой. Например, кальций реагирует с водой с образованием гидроксида кальция и выделением водорода:
- Ca + 2H2O → Ca(OH)2 + H2
Такая реакция является характерной для всех металлов 2а группы. При этом, активность металлов этой группы увеличивается по мере продвижения по периоду. Например, барий, находящийся ниже кальция в периодической системе, реагирует с водой более интенсивно:
- Ba + 2H2O → Ba(OH)2 + H2
Металлы 2а группы также образуют соединения с галогенами - фтором, хлором, бромом и йодом. Например, магний реагирует с хлором, образуя хлорид магния:
- Mg + Cl2 → MgCl2
Также известно, что магний и цинк могут реагировать с кислородом воздуха, образуя соответствующие оксиды. Например, магний может гореть на воздухе, образуя оксид магния:
- 2Mg + O2 → 2MgO
Таким образом, металлы 2а группы обладают химическими свойствами, позволяющими им активно взаимодействовать с водой, галогенами и кислородом воздуха. Эти свойства определяют широкое применение этих металлов в различных отраслях промышленности и научных исследованиях.
Как металлы 2а группы реагируют с водой?

Металлы 2а группы химической таблицы, такие как медь (Cu), серебро (Ag) и золото (Au), проявляют различную активность при контакте с водой. Данные металлы характеризуются непостоянством окислительных свойств и степенью реакционности.
Наиболее активным металлом из 2а группы является медь. При взаимодействии с водой это мягкий и блестящий металл образует гидроксид меди (Cu(OH)2) и выделяет водород. Это свидетельствует о высокой активности меди в реакциях с водой. Реакция меди с водой может быть представлена следующим уравнением: 2Cu + 2H2O → 2Cu(OH)2 + H2.
Серебро, металл с более низкой активностью, также проявляет реакцию с водой. Образование гидроксида серебра (AgOH) и выделение водорода при контакте с водой примерно аналогичны реакции меди: 2Ag + 2H2O → 2AgOH + H2. Однако, реактивность серебра ниже, чем у меди, что говорит о его меньшей склонности к реакциям с водой.
Золото, наименее активный металл из 2а группы, реагирует с водой очень слабо. Этот благородный металл образует всего лишь незначительное количество гидроксида золота (AuOH) и выделяет водород со скоростью, практически неприметной для обозрения. Это говорит о низкой активности золота и его относительной инертности к реакциям с водой.
Таким образом, металлы 2а группы проявляют разную активность взаимодействия с водой. Медь наиболее активна и выделяет водород сразу, серебро реагирует меньше, а золото реагирует с водой весьма слабо.
Особенности реакции алюминия с водой

1. Алюминий пассивирует
При реакции с водой алюминий покрывается оксидной пленкой, что препятствует дальнейшему взаимодействию металла с водой. Таким образом, реакция алюминия с водой происходит нестабильно из-за образования защитного слоя оксида алюминия Al2O3 на поверхности металла.
2. Реакция образует водород
При взаимодействии алюминия с водой образуется водородный газ H2, который освобождается в виде пузырьков. Образование водорода при этой реакции делает ее заметной, так как металл активно реагирует с водой, выделяя значительное количество газа.
3. Взаимодействие сильно зависит от условий
Реакция алюминия с водой может протекать при разных условиях. Например, при комнатной температуре реакция может быть достаточно медленной и незначительной, однако при нагревании алюминия или использовании раскаленной воды процесс обусловлен существенно более интенсивным образованием водорода и разрушением пассивирующей оксидной пленки.
4. Взаимодействие алюминия с водой является экзотермическим
Реакция алюминия с водой сопровождается выделением тепла, то есть является экзотермической. Это связано с энергетически выгодной окислительно-восстановительной реакцией, при которой алюминий окисляется, а водород восстанавливается.
5. Взаимодействие алюминия с водой обладает практическим применением
Реакция алюминия с водой используется в различных технических и химических процессах. Например, для получения водорода в промышленных масштабах можно использовать реакцию алюминия с водой. Кроме того, данная реакция используется и в лабораторных условиях для демонстрации образования водорода при взаимодействии металла с водой.
Титан и его взаимодействие с водой

Титан — это металл, который обладает высокой прочностью, низкой плотностью и химической стойкостью. Он широко используется в промышленности, в том числе в авиации и медицине. Но каково его взаимодействие с водой?
Титан не реагирует с обычной водой при комнатной температуре. Вода не окрашивается и не происходит значительного выделения газов. Однако, при нагревании титана до высоких температур, возможно небольшое взаимодействие с водой.
Титан образует оксидные пленки на своей поверхности, которые способны защищать металл от дальнейшего взаимодействия с водой. Эта пленка хорошо стойка к коррозии и предотвращает продолжительное взаимодействие титана с водой.
Однако, в сильно щелочных или кислых условиях, реакция между титаном и водой может быть наблюдаема. Например, при взаимодействии с концентрированными растворами кислот, титан может образовывать газообразные продукты, такие как водород.
Таким образом, хотя титан не проявляет активную реакцию с водой при комнатной температуре, его взаимодействие может проявиться при определенных условиях, таких как повышенная температура или наличие сильно щелочных или кислых растворов.
Уран и его химические свойства в реакции с водой

Уран – тяжелый радиоактивный металл, который проявляет особые химические свойства при реакции с водой. В отличие от многих других металлов, уран не реагирует с обычной водой при комнатной температуре. Однако, при повышении температуры или наличии активных химических реагентов, уран может образовывать различные соединения.
Одна из самых характерных реакций урана с водой – это образование гидроксида урана (UO2(OH)2). При взаимодействии металлического урана с водой, происходит образование оксидов и гидроксидов урана, которые растворяются в воде, образуя водные растворы.
Уран также может реагировать с кислородом в воде, образуя оксид урана (UO2), который является основным продуктом реакции. Это важное химическое свойство урана позволяет использовать его в ядерной энергетике, где он выступает в качестве ядерного топлива.
Кроме того, уран может образовывать различные комплексные соединения с другими веществами, которые могут оказывать влияние на его химические свойства. Например, при взаимодействии урана с некоторыми органическими соединениями, образуются особые комплексы, которые могут быть использованы в различных областях науки и техники.
В целом, уран и его химические свойства в реакции с водой представляют интерес и значимость для научных и практических исследований. Понимание этих свойств позволяет использовать уран в различных областях, начиная от ядерной энергетики и заканчивая разработкой новых материалов и технологий.
Реакция воды с другими металлами 2а группы
Металлы 2а группы периодической системы, такие как магний (Mg), цинк (Zn) и кальций (Ca), также способны реагировать с водой. Эти металлы реагируют с водой несколько иначе, чем металлы 1а группы.
Магний (Mg) реагирует с водой, образуя гидроксид магния (Mg(OH)2) и выделяя водород (H2). Эта реакция происходит медленно и с образованием слабого щелочного раствора. Реакция магния с водой может быть ускорена, если вода содержит ионы гидроксида (OH-).
Цинк (Zn) реагирует с водой только при нагревании или в присутствии кислорода. При этом образуется гидроксид цинка (Zn(OH)2) и выделяется водород (H2). Реакция цинка с водой является более активной, чем реакция магния с водой.
Кальций (Ca) реагирует с водой очень быстро и интенсивно. При этом образуется гидроксид кальция (Ca(OH)2) и выделяется большое количество водорода (H2). Реакция кальция с водой является самой активной среди металлов 2а группы.
Вопрос-ответ

Какие металлы реагируют с водой, кроме металлов 2а группы?
Кроме металлов 2a группы, также реагируют с водой металлы 1а группы, а также некоторые металлы из группы 3.
Почему металлы 2а группы реагируют с водой?
Металлы 2а группы реагируют с водой, потому что они обладают высокой реакционной способностью. При этом реакция происходит с образованием гидроксидов металлов и выделением водорода.
Какие именно металлы входят в группу 2а?
В группу 2а входят следующие металлы: магний (Mg), цинк (Zn), кадмий (Cd), ртуть (Hg).
