Металлы второй группы (главная подгруппа) периодической системы Менделеева включают такие элементы, как бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы обладают рядом сходных физических и химических свойств, которые определяют их взаимодействие со сложными веществами.
Металлы 2-й группы обладают высокой электропроводностью и теплопроводностью, что делает их незаменимыми материалами для создания электронных и тепловых устройств. Они также обладают высокой пластичностью и тянутостью, что позволяет использовать их для изготовления проводов и других изделий, требующих изгиба и деформации. Кроме того, металлы 2 группы главной подгруппы имеют низкую температуру плавления и высокую плотность, что делает их применимыми в промышленности и строительстве.
Однако, металлы 2-й группы также имеют высокую химическую активность и легко взаимодействуют с другими веществами. Особенно интересным является их взаимодействие со сложными веществами, такими как органические соединения, кислоты и щелочи. При контакте с такими веществами металлы 2 группы могут проявлять различные химические реакции, в результате которых образуются новые соединения и продукты взаимодействия.
Металлы 2 группы главной подгруппы
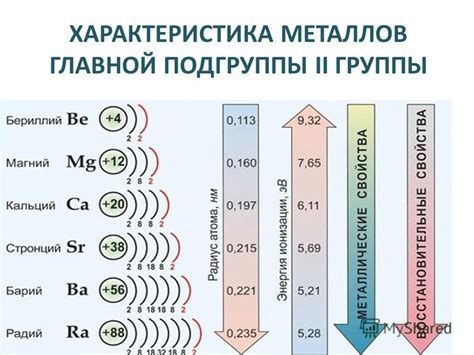
Металлы второй группы главной подгруппы находятся в периодической системе химических элементов между литием и магнием. Они имеют общую характеристику – два электрона на внешней энергетической оболочке и валентность два. К этой группе относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Основной характеристикой металлов второй группы главной подгруппы является их способность образовывать ионы с двумя положительными зарядами. Валентность два означает, что каждый атом металла может потерять два электрона при взаимодействии с другими элементами, образуя двухзарядные катионы. Ионы металлов второй группы главной подгруппы положительно влияют на работу организма человека и являются необходимыми микроэлементами.
Металлы второй группы обладают высокой теплопроводностью, химической инертностью и являются основными компонентами различных сплавов и соединений. Они находят широкое применение в различных отраслях промышленности, таких как производство автомобилей, аэрокосмическая промышленность и энергетика. Кроме того, металлы второй группы имеют важное значение в медицине, где они используются для создания протезов и инструментов.
Взаимодействие металлов 2 группы

Металлы 2 группы главной подгруппы - цинк (Zn), кадмий (Cd) и ртуть (Hg) - имеют определенные особенности взаимодействия с другими веществами.
Цинк, как типичный представитель этой группы, обладает достаточной химической активностью и может вступать в реакции с различными кислотами, образуя соли. Особенно ярким примером такой реакции является взаимодействие цинка с соляной кислотой, при котором происходит выделение газообразного водорода и образование хлорида цинка.
Кадмий, в свою очередь, проявляет большую химическую активность по сравнению с цинком, что связано с большей атомной массой и более слабой связью электронов с ядром. Он вступает в аналогичные реакции с кислотами, образуя соли, однако более энергично и интенсивно.
Ртуть, самый тяжелый и наиболее реакционный металл 2 группы, обладает особыми свойствами и способна взаимодействовать со многими веществами. Ее взаимодействие с кислотами приводит к образованию ртутных солей, а также может протекать с образованием оксидов и других неорганических соединений.
Таким образом, металлы 2 группы главной подгруппы взаимодействуют с различными веществами, образуя соли и другие соединения. Их активность и интенсивность реакций зависят от конкретного металла и условий взаимодействия.
Вопрос-ответ

Какие металлы относятся к 2 группе главной подгруппы?
К металлам 2 группы главной подгруппы относятся медь (Cu), цинк (Zn), никель (Ni) и кобальт (Co).
Каким образом металлы 2 группы главной подгруппы взаимодействуют со сложными веществами?
Металлы 2 группы главной подгруппы могут образовывать различные соединения с комплексами, кислотами и основаниями. Например, медь может образовывать комплексы с аммиаком, а цинк может реагировать с кислотами, образуя соли.
