Металлы 2 группы главной подгруппы периодической системы – это элементы, которые находятся на второй группе периодической таблицы. В эту группу входят такие металлы, как цинк (Zn), кадмий (Cd) и ртуть (Hg). Они обладают рядом общих характеристик, которые делают их отличными от других элементов таблицы.
Во-первых, металлы 2 группы главной подгруппы обладают высокой электропроводностью. Это означает, что они способны легко передавать электроны, что делает их хорошими проводниками электрического тока. Эта характеристика делает эти металлы важными для промышленности, особенно в производстве электроники и электрической проводки.
Во-вторых, металлы 2 группы главной подгруппы имеют химическую реакционность. Они легко образуют соединения с другими элементами, что делает их полезными в различных химических процессах. Например, цинк используется в гальванических элементах и защите от коррозии, кадмий применяется в производстве аккумуляторов, а ртуть используется в термометрах и других приборах.
В-третьих, металлы 2 группы главной подгруппы обладают разными физическими свойствами. Например, ртуть является единственным металлом, который находится в жидком состоянии при комнатной температуре. Кадмий и цинк – твердые металлы, которые имеют высокую температуру плавления и плотность.
Химические элементы и их свойства
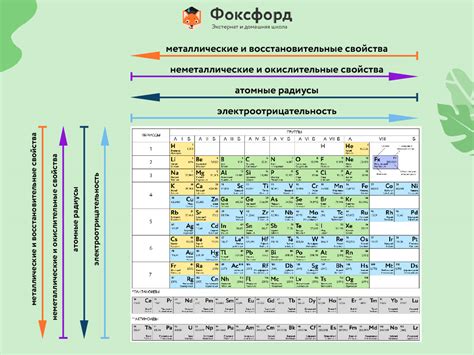
Химические элементы - это вещества, не поддающиеся разложению на более простые вещества химическими методами. Химические элементы являются основными строительными блоками всех веществ, включая живые организмы.
На данный момент в периодической системе химических элементов известно 118 элементов. Они разделены на различные группы и подгруппы в зависимости от их характеристик и свойств.
Элементы 2 группы главной подгруппы обладают рядом общих характеристик. Они включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Основные характеристики элементов второй группы главной подгруппы включают их атомные номеры, относительные атомные массы, электронную конфигурацию и химические свойства.
Например, магний (Mg) имеет атомный номер 12 и относительную атомную массу 24,31. Его электронная конфигурация состоит из двух внутренних электронов и восьми валентных электронов. Магний является алкалиноземельным металлом и проявляет свойства таких металлов, как высокая теплопроводность, хорошая электропроводность и реактивность с кислородом и некоторыми кислотами.
Кальций (Ca), в свою очередь, имеет атомный номер 20 и относительную атомную массу 40,08. Его электронная конфигурация также включает два внутренних электрона и восемь валентных электронов. Кальций является щелочноземельным металлом и известен своей способностью реагировать с водой и кислородом, а также образовывать осадки в виде карбонатов и сульфатов.
Таким образом, элементы второй группы главной подгруппы обладают своими уникальными химическими свойствами, которые определяют их положение и роль в периодической системе химических элементов.
Вещества и соединения
Металлы 2 группы главной подгруппы периодической системы являются активными элементами, способными образовывать различные вещества и соединения. Они обладают высокой химической реактивностью и могут образовывать разнообразные соединения с другими элементами.
Первым важным свойством этих металлов является их способность образовывать сплавы с другими элементами. Путем смешивания с другими металлами или неметаллами эти металлы могут формировать новые материалы с уникальными свойствами и характеристиками. Например, сплавы из цинка и меди, такие как латунь, обладают повышенной прочностью и коррозионной стойкостью.
Вторым важным аспектом веществ и соединений данных металлов является их способность образовывать соли с кислотами. Металлы 2 группы могут образовывать солевые соединения, путем реакции с различными кислотами. Например, магний, который относится к этой группе, может образовывать сульфат магния (MgSO4), карбонат магния (MgCO3) и другие солевые соединения.
Третьим важным свойством данных металлов является их способность образовывать гидроксиды. При взаимодействии с водой эти металлы образуют гидроксиды, которые обладают щелочными свойствами. Например, бериллий образует гидроксид бериллия (Be(OH)2), а стронций - гидроксид стронция (Sr(OH)2).
Физические свойства и состояние

Металлы 2 группы главной подгруппы периодической системы обладают рядом характерных физических свойств, которые определяют их состояние в природе и при возможном использовании.
Первое из них – металлический блеск. Эти металлы отличаются ярким блеском на поверхности, подобного зеркалу, который обусловлен рассеянием входящих световых лучей.
Второе свойство – высокая пластичность. Это означает, что эти металлы могут быть легко заформованы путем проката, тяжелого штампования и других методов обработки.
Третье важное свойство – электропроводность. Металлы 2 группы обладают высокой способностью проводить электрический ток, что делает их полезными для создания электрических цепей и компонентов.
Определенное вещество может находиться в разных состояниях. Металлы 2 группы главной подгруппы периодической системы находятся в твердом состоянии. Твердое состояние обусловлено структурой и связями между атомами вещества, что делает их прочными и устойчивыми.
Применение в промышленности и науке

Металлы 2 группы главной подгруппы периодической системы имеют широкое применение в промышленности и науке благодаря своим уникальным характеристикам и свойствам.
Одним из основных применений металлов этой группы является их использование в авиационной и космической промышленности. Материалы, содержащие эти металлы, обладают высокой прочностью, легкостью и устойчивостью к высоким температурам, что делает их незаменимыми для создания надежных конструкций самолетов, ракет и спутников.
Еще одним важным применением металлов 2 группы является их использование в электронной промышленности. За счет высокой электропроводности и электронной структуры, эти металлы и сплавы широко применяются в производстве электродов, контактов, проводов и других компонентов электронных устройств. Благодаря своим электронным свойствам, металлы 2 группы также широко используются в научных исследованиях в области электроники и физики твердого тела.
Кроме того, металлы 2 группы находят применение в химической промышленности. Некоторые из них, например, цинк и кадмий, используются в процессах гальванического покрытия для защиты металлических поверхностей от коррозии. Другие металлы этой группы, такие как медь и никель, применяются в качестве катализаторов в химических реакциях, благодаря своей способности активизировать и ускорять процессы.
Таким образом, металлы 2 группы главной подгруппы периодической системы играют важную роль в промышленности и науке, обеспечивая надежность и эффективность различных процессов и технологий.
Вопрос-ответ

Какие элементы относятся к металлам 2 группы главной подгруппы периодической системы?
К металлам 2 группы главной подгруппы периодической системы относятся магний (Mg) и кальций (Ca).
Какие общие характеристики у металлов 2 группы главной подгруппы периодической системы?
Металлы 2 группы главной подгруппы периодической системы характеризуются следующими особенностями: они обладают металлическим блеском, хорошей тепло- и электропроводностью, имеют высокую пластичность и формоизменяемость, образуют ионы с положительным зарядом.
Какие свойства металлов 2 группы главной подгруппы периодической системы делают их ценными материалами?
Металлы 2 группы главной подгруппы периодической системы, такие как магний и кальций, обладают рядом свойств, которые делают их ценными материалами. Они имеют низкую плотность, высокую прочность и жаропрочность, хорошую коррозионную стойкость и отличные свойства магнитности. Это делает их необходимыми во многих отраслях промышленности, таких как авиация, автомобильное производство, электроника и др.
